如果说人体是一架精密运行的机器,那么癌细胞无疑就是其中的捣蛋分子。它们到处乱逛、侵占资源,还要拉拢健康细胞离经叛道,加入搞破坏的行列。
这些古怪的细胞有很多匪夷所思的地方,其中一个就是它们的能量来源。根据著名的 Warburg 效应,癌细胞偏向于使用低能效的糖酵解供能。攻城掠地需要大量的能量,为何癌细胞放着足够的氧气不用,偏偏要选择看起来性价比很低的糖酵解呢?
有句俗话叫做无利不起早。我们讲过那么多癌细胞狡猾奸诈的故事,人类之敌怎么可能在这么重要的事情上犯傻呢!
今天顶级期刊《自然》突然更新的就是这样一项重磅研究:贝勒医学院 Bert O’Malley 教授团队终于破解了癌细胞有氧环境下依旧选择糖酵解供能的谜团!研究者首次发现糖酵解过程的关键果糖激酶 PFKFB4 竟然也能够修饰蛋白质!该酶可以作用于转录激活蛋白 SRC-3,增加其转录活性,进而成为乳腺癌细胞增殖和转移的帮凶 [1]!
研究者发现,消融肿瘤组织中的 PFKFB4 或 SRC-3,可以几乎完全消除乳腺癌复发和转移的可能。通过修改 SRC- 3 使其不能被 PFKFB4 修饰,也达到了同样的效果。

Bert O'Malley 教授
分子内分泌学之父
1924 年,德国生理学家 Otto Warburg 提出了(比起诺奖)让他留名后世的理论——Warburg 效应。他认为,癌细胞之所以生长速度远大于正常细胞,就是因为能量的获取方式不同。一般,正常细胞会选择有氧呼吸的方式供能,而癌细胞却倾向于使用糖酵解。所以癌细胞的线粒体应当与正常细胞有所不同,这种差异应该就是癌症真正的起源。
要知道,同样是一分子葡萄糖,有氧呼吸能够产生 36 分子 ATP,但是糖酵解就只能产生 2 分子 ATP。高达十几倍的能量差距啊,更何况癌细胞疯狂增殖、流窜,这都需要大量的能量。癌细胞为什么要选择这种效率低下的途径?
无疑,这是个反直觉的理论,因此 Warburg 也“收获”了大量来自同行的口诛笔伐。现在主流研究者一般认为,癌症为突变引起。在恶性转化过程中,基因突变导致表达的变化,进而造成细胞的无节制生长。而代谢选择的变化,只是癌细胞适应实体瘤内缺氧环境的结果而已。
无论真相如何,癌细胞偏爱糖酵解是不争的事实,由此而来的问题就是,糖酵解是否确实对癌症进展有帮助?如果真的有,那么这又是如何实现的呢?

Otto Warburg 本瓦
朋友圈包含爱因斯坦等大牛,差点拿了两次诺奖
癌变的两个最大的特征就是代谢和转录的变化,它们又分别与癌症的增殖和转移相关 [2],不过这二者之间的关系就有些不那么能说清楚了。而本项研究的发现,说起来还有点意外。
在几年前,O’Malley 教授实验室确定了一种转录蛋白在癌症中的作用。这种蛋白名为类固醇受体共激活因子 3(SRC-3,也称为 NCOA3 等),SRC- 3 是一种重要的基因表达调控因子,能够上调基因的表达,在许多癌细胞中都存在过表达现象 [3]。而且对 SRC- 3 进行磷酸化修饰,还能够进一步提升它的转录活性,SRC- 3 的磷酸化也是许多癌症的生物标志[4]。
为了搞清楚影响 SRC- 3 转录活性的激酶,研究者们开始了大海捞针。他们利用反义 RNA 对 636 种人类激酶与 SRC- 3 的相互作用进行了筛选,成功找到了对 SRC- 3 影响最大的一种激酶,PFKFB4。
这可令人惊讶了。PFKFB4 固然是一种激酶,却并不是一种蛋白激酶,而是在糖酵解过程中起关键作用的一种果糖激酶!此前可没人知道,这种酶还能作用于蛋白质。
进一步的研究显示,PFKFB4 可以在 SRC- 3 蛋白 857 号位的丝氨酸上添加磷酸基团,从而增加 SRC- 3 的转录活性,促进乳腺癌的增殖和转移。那么反过来想想,限制住这两种蛋白,是不是可以控制癌症发展呢?
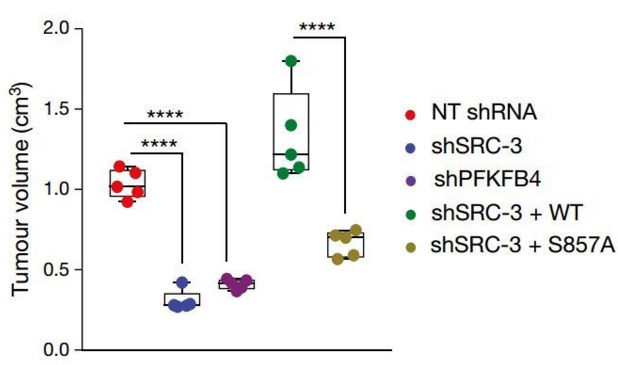
研究者设计了一组人源乳腺癌细胞,细胞中能够稳定地表达靶向 PFKFB4 或 SRC- 3 的短发卡 RNA。这就有效地沉默了癌细胞中 PFKFB4 和 SRC-3。
研究者将这种癌细胞移植给小鼠,并持续观察肿瘤组织的生长情况。与对照组小鼠相比,任意一者被沉默的小鼠肿瘤组织发展都明显受到抑制(下图左 1、2、3)。如果给 SRC- 3 沉默的小鼠补充正常的 SRC-3,那么小鼠的肿瘤生长也会恢复正常(下图左 4)。
除此之外,研究者还设计了一种无法被 PFKFB4 磷酸化的 SRC-3(S857A)。利用这种改造的 SRC- 3 替换正常 SRC- 3 也能够一定程度上阻止癌症发展(下图左 5)。
在预防癌症复发转移上,这种方法也起到了良好的效果。
研究者给小鼠植入癌细胞 6 周后,再为小鼠手术清除原发瘤,并在接下来的 4 周里持续观察小鼠复发的情况。正常小鼠普遍表现为大规模的肺部的转移复发。
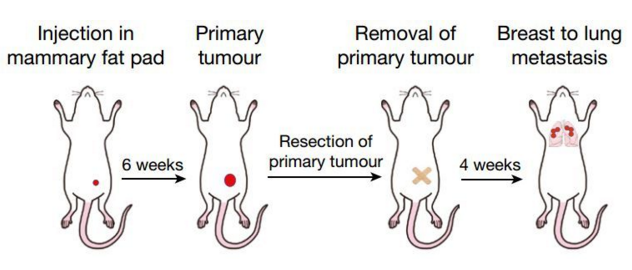
实验流程
但是对于那些植入“改造”癌细胞的小鼠来说,它们的肺部只是发现了几个零星的转移灶,而且在手术之后的四周内并没有出现什么健康问题。
这些结果足以说明 PFKFB4—SRC- 3 通路在乳腺癌增殖和转移过程中的重要作用了。
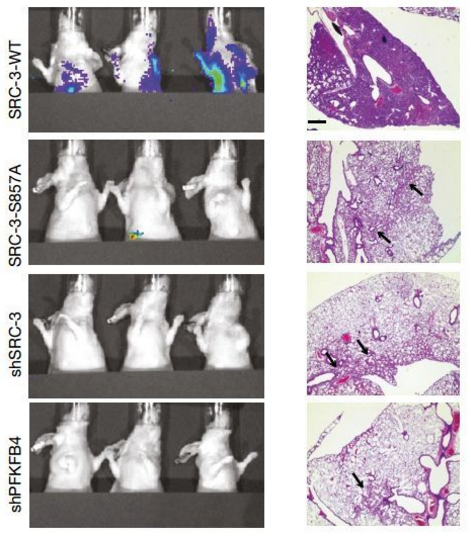
影像学检查和组织病理学检查
这条新发现的通路在临床上也能够得到一定的验证。研究者对癌症基因组图谱数据库(TCGA)中的数据进行了分析,发现在所有乳腺癌的亚型中,都存在 PFKFB4 表达增加;而与正常组织相比,肿瘤组织中 PFKFB4、SRC3、磷酸化 SRC- 3 水平都有显著的增加,并且与不良预后有关。
现在让我们回到 Warburg 效应上来。现在我们知道,癌细胞到底为什么选择了看起来吃力不讨好的糖酵解,自然是因为糖酵解途径会协助癌细胞壮大自己咯。去年《自然通讯》也曾发表一项研究,发现糖酵解过程中产生的 1,6- 二磷酸果糖能够促进 RAS 基因的超活化 [5]。
参考资料:
[1] https://www.nature.com/articles/s41586-018-0018-1
[2]Ward, P. S. & Thompson, C. B. Metabolic reprogramming: a cancer hallmark even Warburg did not anticipate. Cancer Cell 21, 297–308 (2012).
[3] Xu, J., Wu, R. C. & O’Malley, B. W. Normal and cancer-related functions of the p160 steroid receptor co-activator (SRC) family. Nat. Rev. Cancer 9, 615–630(2009).
[4] Lonard, D. M. & O’Malley, B. W. The expanding cosmos of nuclear receptor coactivators. Cell 125, 411–414 (2006).
[5] https://www.nature.com/articles/s41467-017-01019-z
来源:奇点网