2021年4月4日 讯 /生物谷BIOON/ 细胞系的遗传不稳定性和细胞系污染揭示了广泛和系统的问题,可以显著损害可靠性和科学数据的再现性。同样,鼠逆转录病毒如鼠白血病病毒或EBV在PDX模型已在小的数据集报道。但是,由于缺乏可用数据,这些评估非常有限。
基于此,德克萨斯大学健康科学中心 W. Jim Zheng 副教授、安志强教授团队在 《Nature Communications 》期刊发表了题为:“Presence of complete murine viral genome sequences in patient-derived xenografts”的研究论文。揭示了以前未显示的PDX模型中鼠类病毒的广泛存在和持续存在,并引起了人们对其病毒作为癌症药物开发的重要平台对PDX模型的影响的严重关注。

该研究团队从公开可用的RNA-seq原始读数(开始评估了PDX肿瘤中病毒序列的存在 ,并分析了无法映射到基因组的序列读数PDX肿瘤。该研究团队使用的数据是从这些实验的对照中精心选择的,大多数样品来自直接从患者身上获得的肿瘤,然后未经修饰地移植到小鼠中。因此,这些样品没有经过操作,改造或萤光素化处理,从而使该研究团队避免了可能使分析复杂化的任何人工病毒序列。
接下来,该研究团队发现,在没有小鼠暴露的情况下,单细胞测序的PDX肺癌样本中的鼠类病毒序列读数明显高于相应的原发性肿瘤 。此外,病毒读取来自PDX样本覆盖的病毒的整个基因组区域,尽管低读计数由于单细胞测序技术。在对照样品中,没有病毒读数可以定位到鼠病毒基因组。此外,PDX和原代细胞培养物之间的少量读数可映射到小鼠基因组之间没有显着差异。这些读数分散在整个小鼠基因组上,覆盖深度很低。因此,它们不是真正的鼠标读取,而是序列噪声。与对PDX肿瘤或细胞培养物进行的批量测序不同,单细胞测序可检测单个细胞中的RNA分子,并且该方案无法污染游离病毒。由于从这些细胞读取的大多数序列都已定位到人类基因组,因此该研究团队可以确定这些序列来自单个人类肿瘤细胞。这些结果提供了直接的证据来支持该研究团队的假设,即鼠源性病毒不仅是鼠类组织或血液的污染,而且是PDX肿瘤细胞内部的。
最后,通过溶瘤病毒或其他病毒在癌症患者中重建病毒载量高的肿瘤环境的一种可能方法,因为该研究团队观察到这些病毒感染后的肿瘤细胞中以及鼠类病毒感染的PDX中某些共有的基因表达发生了变化。如果这种环境导致患者的肿瘤细胞具有与该研究团队在PDX肿瘤中观察到的相似的基因表达变化,则可能会改变肿瘤对药物的敏感性。反过来,这可能有助于恢复一些在高病毒载量的PDX模型中效果很好的药物线索,但在参与者的原发肿瘤中没有病毒的临床试验中却不能。支持这一观点的是,溶瘤病毒感染可以提高药物线索的效力。例如,H-1PVs,一种大鼠原发性细小病毒,用作临床治疗中的溶瘤病毒。此外,溶瘤病毒可以刺激肿瘤中的免疫抑制微环境,并与免疫疗法协同地攻击肿瘤细胞。
综上所述,结果还表明,在鼠类异种移植物中使用人源组织进行的实验需要更多的质量控制。对于此类实验,应实施常规卫生和病原体控制以及病毒感染的风险评估。令人惊讶的是,该研究团队检测到的病毒并未包含在由IDEXX BioAnalytics等公司提供的商业解决方案中,IDEXX BioAnalytics为大多数(即使不是全部)PDX核心设施提供病毒监控和检测产品。为防止病毒感染和传播,应定期对动物模型进行尽可能广泛的病毒感染测试。这种做法可能会对PDX模型上癌症药物开发的成功产生深远影响。
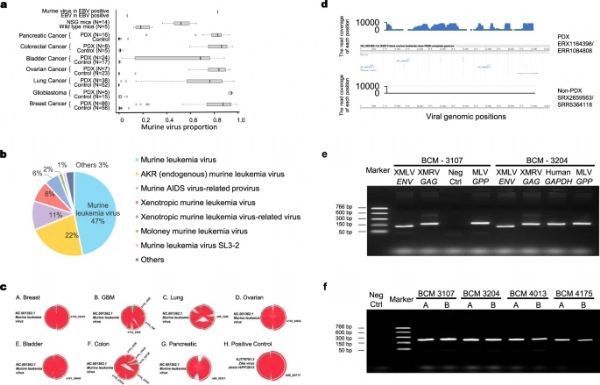
各种PDX肿瘤样品和相应的对照, doi:10.1038/s41467-021-22200-5

