中国医学科学院北京协和医学院生物医学工程研究所黄鹏羽研究员、张明明副研究员等在 Advanced Science 期刊发表了题为:Rapid Self-Assembly Mini-Livers Protect Mice Against Severe Hepatectomy-Induced Liver Failure 的研究论文。
该研究开发了一种简单且省时的方法,可在12小时内创建快速自组装迷你肝脏(RSAL)。RSAL表现出一致的较大尺寸(直径5.5毫米)、更好的细胞活力(99%)和增强的肝脏功能。RSAL还有效保护了小鼠免受90%肝脏切除引起的肝衰竭,证明了基于生物人工肝的治疗潜力。

近年来,肝脏类器官领域取得了许多显著进展,但在大规模制造生物人工肝组织时,仍然面临着许多重大挑战。其中一个主要的挑战是获取足够数量的安全、可靠和功能性的肝细胞作为种子细胞。虽然已经进行了大量的研究工作,致力于诱导多能干细胞(iPSC)、胚胎干细胞(ESC)和转分化细胞,但与畸胎瘤形成、基因组不稳定性、高成本、耗时和复杂的过程以及功能有限等问题相关的持续担忧继续阻碍着该领域进展。而最近在原代肝细胞的体外扩增方面取得了实质性进展,提供了一种更具成本效益和更安全的肝细胞来源。
当前技术在生产更大的肝组织时存在着明显限制,当类器官的大小增加时,由于有毒代谢废物的积累和局部氧气和营养物质的耗竭,会出现坏死等问题。肝脏类器官的生长速度缓慢进一步加剧了这些问题。因此,迫切需要探索快速组装高密度肝细胞的策略,以最小化坏死核心并增加生物人工肝的大小。
在应对上述挑战时,研究团队将注意力集中在纤维蛋白上,这是一种天然产生的聚合物,在凝血的最后阶段至关重要。在这个复杂的生理过程中,伤口暴露于空气会引发一系列反应,包括血管收缩和血小板聚集。这个序列中的关键步骤是凝血酶的激活,它将血管中的可溶性纤维蛋白原转化为不溶性纤维蛋白链。这些纤维蛋白链形成一个网状或支架,捕获血细胞,特别是红细胞和血小板,形成一个稳定的血凝块,阻止进一步的失血并促进伤口愈合。
这种体内凝血过程可以在体外有效地模拟,其中凝血酶将纤维蛋白原转化为纤维蛋白。纤维蛋白基质中存在Arg-Gly-Asp (RGD) 基序,通过与细胞整合素受体的相互作用促进细胞粘附,使纤维蛋白成为增强各种细胞活动的理想支架,包括粘附、增殖和分化。由于其易于制备、可调节性、细胞支持、生物相容性和固有的生物安全性,纤维蛋白在再生医学领域得到了广泛应用。此外,琼脂糖通常用于球状体生成,因为它具有提供非粘附凹面的特性,可以防止细胞附着在培养皿底部。
在这项研究中,研究团队利用纤维蛋白原和凝血酶的自然生理凝血过程,设计了一种快速自组装迷你肝脏(RSAL)。添加到细胞-纤维蛋白原溶液中的凝血酶启动了纤维蛋白原的裂解,形成肝细胞聚集的支架。因此,一个微型肝脏球状体在琼脂糖的凹底支撑下形成。
该研究开发了一种简单而高效的方法,可以在12小时内快速自组装迷你肝脏(RSAL),此外,原代肝细胞在体外被显著扩增,可作为种子细胞使用。RSAL表现出一致的大尺寸(直径达5.5毫米)、更高的细胞存活率(99%)和增强的肝脏功能。
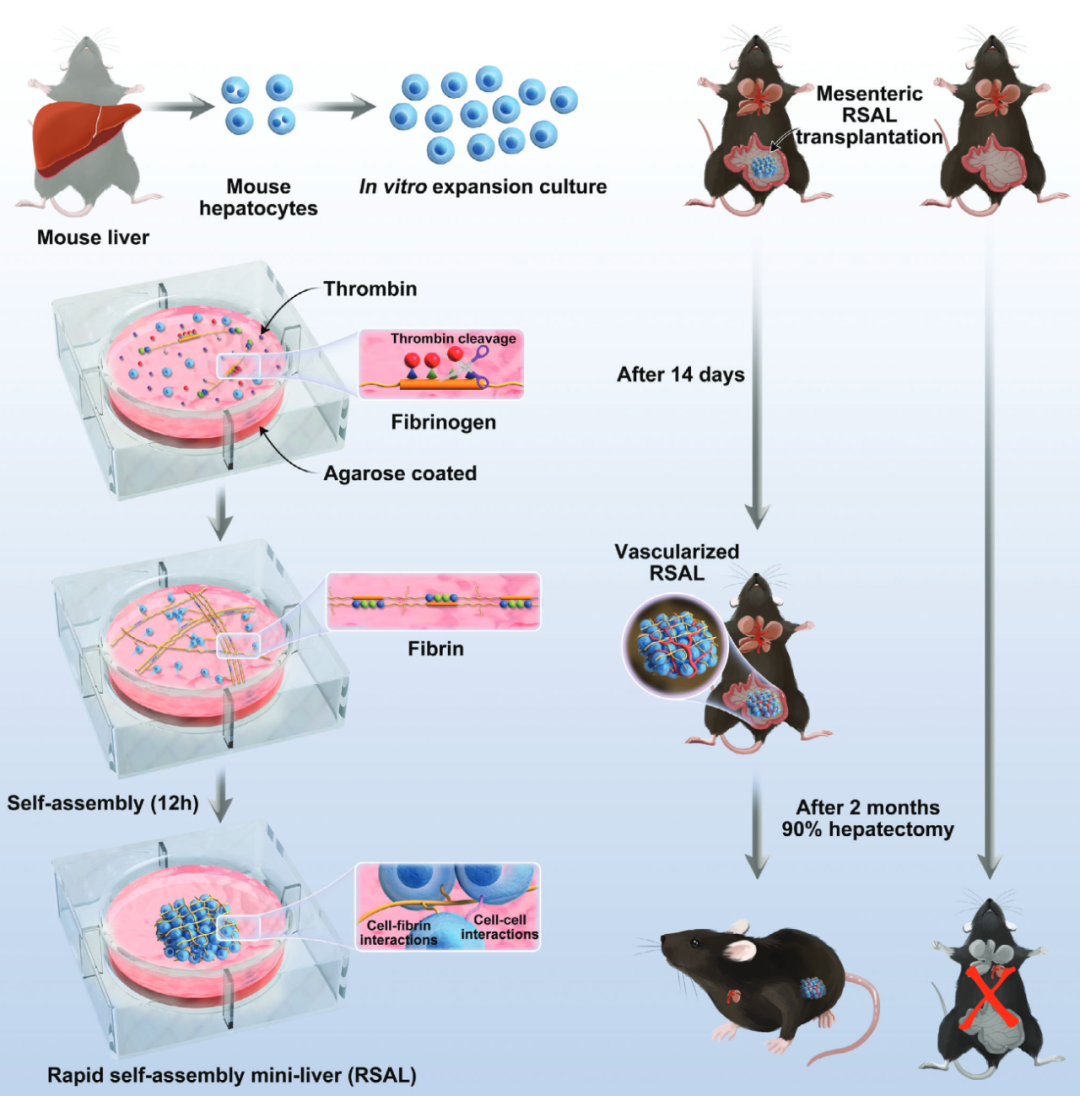
值得注意的是,在移植到小鼠肠系膜后2周内,RSAL产生了功能性血管化。这些基于真实肝细胞的RSAL有效地保护小鼠免受90%肝脏切除诱发的肝衰竭,展示了基于生物人工肝的治疗潜力。

