同济大学陈嘉瑜、高绍荣、江赐忠及高睿共同通讯在Developmental Cell 在线发表题为“Defining a TFAP2C-centered transcription factor network during murine peri-implantation”的研究论文,该研究使用uliCUT&RUN-seq描述了一个以TFAP2C为中心的调控网络,表明它涉及启动子-增强子相互作用,并调节TEAD4和KLF5功能来介导细胞极化。
值得注意的是,该研究发现母体维甲酸代谢通过诱导活性的SINEs去甲基化来调节TFAP2C的表达和功能,这表明RARG-TFAP2C-TEAD4/KLF5轴将母体到合子的转变与极化联系起来。此外,还发现基因组印迹和SNP转移的遗传信息都可以影响TF定位,从而以复杂的方式调节亲本基因的表达。综上所述,该研究提出了一个以TFAP2C为核心元件,以代谢、表观遗传和遗传信息为连接通路节点的TF调控小鼠胚胎发育的三元模型。

哺乳动物胚胎发育从受精到原肠胚形成的过程涉及到细胞潜能的一系列有序变化,从受精卵获得全能性到囊胚的细胞命运特化。这些阶段导致胚胎和胚胎外谱系的形成,胚胎体最终由此产生。细胞状态的转变是在不同的分子水平上精确控制的,包括表观遗传、转录和转录后水平,它们是防止发育缺陷或胚胎致死的先决条件。
适当的表观遗传重编程对于基因在早期发育中的精确调控至关重要。DNA甲基化组、组蛋白修饰、染色质可及性和高阶染色质组织的全基因组重编程是配子体发生和胚胎发生的重要方面。随着超灵敏染色质分析方法的快速发展,这一关键发育时期的表观遗传机制的独特原理逐渐被发现。
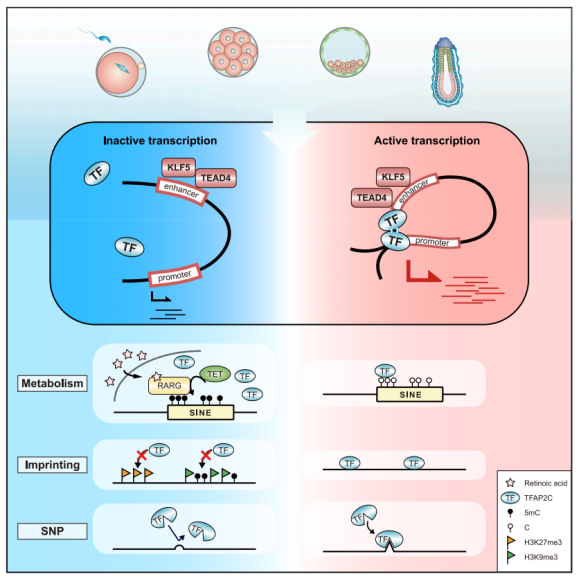
模式图(Credit: Developmental Cell)
细胞命运的决定主要是由转录因子(TFs)和染色质修饰因子的集体作用协调的,并且先前的研究已经阐明了某些关键TFs在早期胚胎发育中的分子功能。然而,由于细胞数量有限和TFs的短暂占用,在很大程度上缺乏TFs和染色质调节因子的占用图谱,无法全面理解在早期胚胎发生过程中决定细胞身份的特定发育基因是如何重新连接的。此外,协调TF作用的调控途径以及基因组上合适的TF定位和功能的有限位点数量也尚不清楚。
该研究清楚地阐明了以TFAP2C为中心的TF网络对早期胚胎发育的微调调控,该网络连接配子遗传代谢基因、亲本遗传环境和表观基因组,共同调节早期胚胎发育。这个RARG-TFAP2C-TEAD4/KLF5轴涉及启动子-增强子(P-E)环,它正确地连接了母系到合子的转变(MZT)和细胞极化,这为转录调控的复杂性提供了前所未有的视角。胚胎可以利用配子遗传的代谢、表观基因组和遗传背景在不同程度上共同调节结合,从而精心决定最终的转录结果。对这些协同活动的研究可以帮助研究人员进一步破译早期胚胎发生的调控转录基础。

