细胞凋亡是一种高度保守的过程,在我们日常生活中的生理和病理条件下都会发生。数十亿细胞每天都经历着凋亡,产生大量的凋亡小泡(Apov),这对维持器官和身体的动态平衡至关重要。ApoV是细胞凋亡过程中释放的一种特殊类型的胞外小泡,包括1~5μm的凋亡小体、0.1~1μm的凋亡微泡和直径小于150 nm的凋亡外体,携带着从亲本细胞遗传来的蛋白质、核酸、脂类和其他分子。
在细胞凋亡过程中,大量与核相关的成分,包括蛋白质和核酸,被包装成ApoVs,使它们有别于生理释放的细胞外囊泡。这些遗传的核材料在载脂蛋白中的作用尚未完全阐明。
DNA损伤通常发生在人体内,由各种因素引起,如紫外线辐射、X射线、γ射线、化学试剂和活性氧物种(ROS)。DNA损伤的积累会导致衰老和癌症。众所周知,细胞具有一个复杂的DNA修复系统来处理DNA损伤,但是否有凋亡代谢参与DNA修复尚不清楚。
辐射损伤被认为是一种严重的临床疾病,必须在战争中甚至在日常生活中预防,这一挑战预计在未来将变得越来越重要。然而,世界卫生组织(WHO)提供的2023年辐射和核紧急情况关键药物清单并不包括任何专门用于促进DNA损伤修复的药物。因此,迫切需要开发实用的治疗方法来修复DNA损伤。

图片来源:https://doi.org/10.1002/jev2.12428
近日,来自中国医科大学的研究者们在J Extracell Vesicles杂志上发表了题为“Apoptotic vesicles are required to repair DNA damage and suppress premature cellular senescence”的文章,该研究揭示了细胞凋亡囊泡是修复DNA损伤和抑制细胞过早衰老所必需的。
众所周知,DNA损伤会导致细胞凋亡。然而,细胞凋亡及其代谢产物是否有助于DNA修复在很大程度上是未知的。在这项研究中,研究者发现凋亡缺陷的Fasmut和BIM−/−小鼠表现出显著的DNA损伤和细胞过早衰老,同时16000g凋亡小泡(Apov)的数量显著减少。
静脉输注骨髓间充质干细胞来源的16,000g载脂蛋白可以挽救Fasmut和BIM−/−小鼠的DNA损伤和过早衰老。此外,亚致死剂量的辐射暴露导致Fasmut小鼠出现比野生型小鼠更严重的DNA损伤、存活率下降和体重减轻,但这些都可以通过输注MSC-apov来恢复。
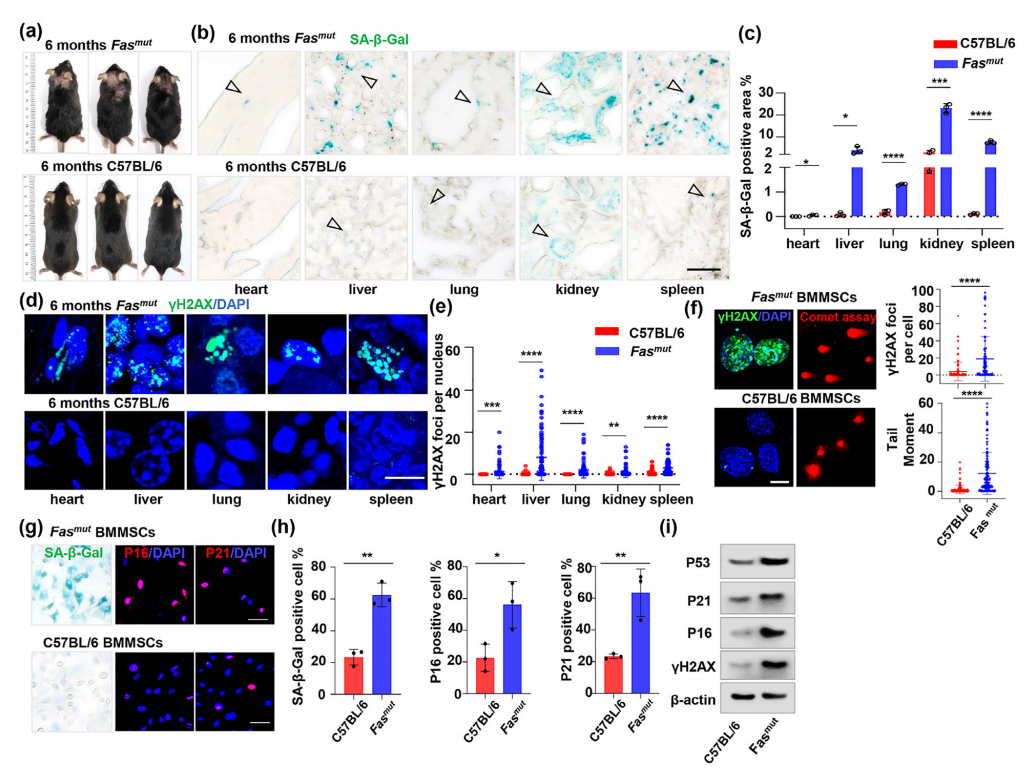
凋亡缺陷的Fasmut小鼠表现出过早衰老和DNA损伤的表型
图片来源:https://doi.org/10.1002/jev2.12428
从机制上讲,研究者证明了细胞凋亡可以将多种核DNA修复酶,如全长的PARP1,组装成16,000克的载脂蛋白。这些DNA修复成分通过16,000g apov直接转移到受体细胞,从而挽救DNA损伤并消除衰老细胞。
最后,研究者证明了胚胎干细胞来源的16,000g载脂蛋白具有优越的DNA修复能力,因为它含有高水平的核DNA修复酶来拯救受到致命剂量辐射的小鼠。这项研究不仅揭示了凋亡囊泡在DNA保护方面的巨大作用,更展示了干细胞衍生囊泡在对抗辐射伤害上的无限潜力。
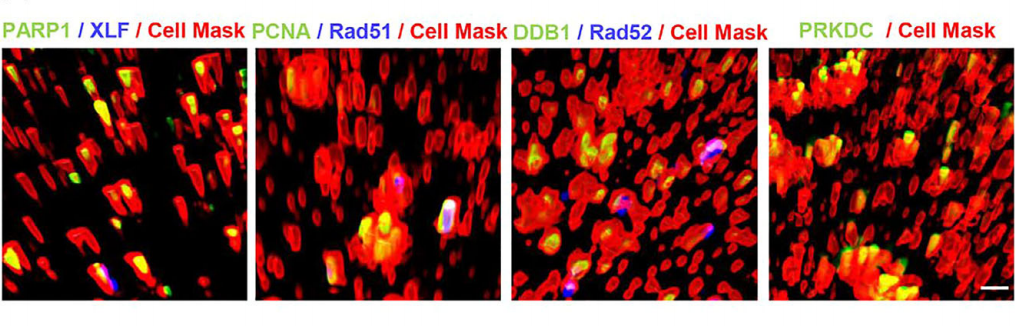
细胞凋亡产生含有丰富DNA修复相关蛋白的apoV复合体
图片来源:https://doi.org/10.1002/jev2.12428
综上所述,在本研究中,研究者证明ApoV数量的减少会导致显著的早衰和DNA损伤,而MSC-apov的输注可以改善这些疾病。同时,研究者首次揭示了细胞凋亡通过产生含有丰富DNA修复酶的DDR-apoV复合体来参与DNA修复。


