富含亮氨酸的重复序列含有g蛋白偶联受体4 (LGR4),其特征是一个长胞外结构域,其中包含多个富含亮氨酸的重复序列。它广泛表达于消化器官、胚胎、下丘脑、软骨到毛囊等组织中。在肠道中,LGR4大量表达并有助于维持肠道内稳态。Lgr4的整体缺乏会损害肠道的发育,其特征是在E16.5时缺乏Lgr5+/Olfm4+肠道干细胞,抑制Wnt信号传导,阻断肠上皮细胞的增殖和分化。有趣的是,Lgr4缺乏似乎只阻碍Paneth细胞的终末分化,Paneth细胞的显著减少和随后黏膜损伤的加重使Lgr4 d高效小鼠易患葡聚糖硫酸钠诱导的炎症性肠病。肠道LGR4是否影响营养吸收和能量稳态尚不清楚。
肠细胞对脂肪酸、氨基酸和葡萄糖等营养物质的吸收对全身能量稳态有重大影响。抑制肠道脂质分解和吸收是干预肥胖和相关代谢紊乱的有效方法。传统上,每个吸收肠细胞被认为能够同时吸收多种营养物质。目前的研究提供了挑战这一经典概念的证据,支持吸收性肠细胞的细胞异质性。利用单细胞RNA测序分析,研究者发现吸收性肠细胞包含三个不同的群体:长链脂肪酸吸收选择性细胞,碳水化合物吸收选择性细胞,长链脂肪酸和碳水化合物吸收非选择性细胞。

图片来源:https://doi.org/10.1038/s41467-024-48622-5
近日,来自北京大学基础医学院生理与病理生理教研室的研究者们在Nat Commun杂志上发表了题为“Reduction of specific enterocytes from loss of intestinal LGR4 improves lipid metabolism in mice”的文章,该研究揭示靶向肠道LGR4是干预肥胖和肝脏脂肪变性的潜在策略。
g蛋白偶联受体4(LGR4)在消化器官中大量表达,其在肠道发育中的作用一直是人们关注的焦点。但是含有LGR4的肠道富含亮氨酸重复序列是否影响营养吸收和能量稳态尚不清楚。本研究将肠道LGR4的生理功能扩展到调节脂质吸收和脂质稳态。
利用遗传学方法在肠上皮中特异性敲除Lgr4基因,研究者证明了肠道Lgr4的代谢益处与肠道Lgr4的代谢效率有关。肠道上皮中Lgr4的下调使小鼠对高脂肪饮食诱导的肥胖及其相关代谢紊乱产生抗性。在Lgr4iKO小鼠中观察到肥胖和肝脏脂肪变性显著减少。脂质代谢的改善似乎不归因于能量消耗,因为冷暴露诱导的产热、体力活动和呼吸商没有改变。
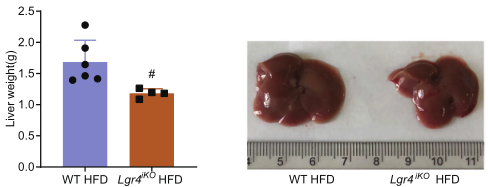
肠道Lgr4缺乏可保护小鼠免受高脂肪饮食诱导的肝脏脂肪变性
图片来源:https://doi.org/10.1038/s41467-024-48622-5
相反,脂质吸收的减少保护Lgr4iKO小鼠免受高脂肪饮食诱导的脂质紊乱。在给予脂质后不久,与野生型仔鼠相关的Lgr4iKO小鼠的血浆甘油三酯和肠上皮内脂滴水平显著降低。另一方面,Lgr4iKO基因的粪便脂质水平升高。所有这些观察结果表明,Lgr4iKO小鼠的脂质吸收显著减少。脂质吸收减少的代谢益处是显著的。肠上皮敲除Lgr4的小鼠对高脂肪饮食诱导的肥胖、肝脏脂肪变性和糖耐量下降具有抗性。有趣的是,虽然腹腔内葡萄糖耐量显著改善,但口服葡萄糖耐量没有改变。这一结果表明Lgr4iKO在肠道中的葡萄糖吸收显著增加。
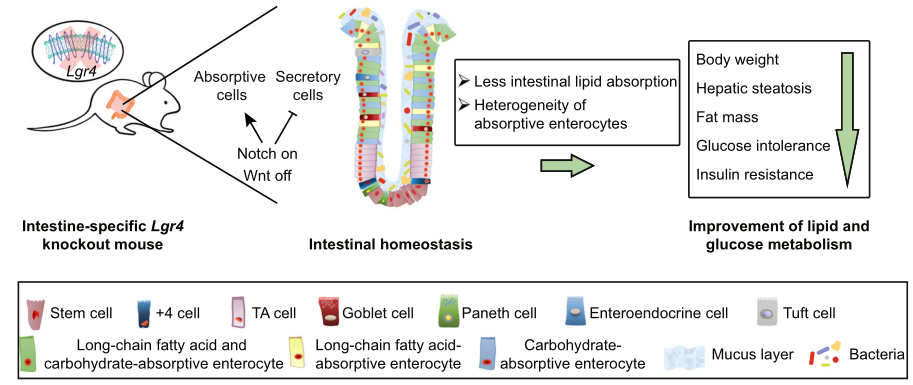
肠道LGR4缺失导致的特异性肠细胞减少可改善小鼠脂质代谢
图片来源:https://doi.org/10.1038/s41467-024-48622-5
综上所述,本研究表明,肠上皮中Lgr4基因的消融通过激活Notch并同时抑制Wnt信号通路影响干细胞分化,干细胞分化的这种偏向导致脂质吸收肠细胞比例减少,导致脂质吸收减少,随后葡萄糖和脂质代谢改善。本研究结果揭示了肠道吸收细胞的细胞异质性,以及肠道LGR4在控制选择性吸收脂质的肠细胞分化中的关键作用。因此,本研究表明,靶向肠道LGR4可能为肥胖和肝脏脂肪变性的干预提供了一种潜在的策略。


