胃肠道(GI)是哺乳动物机体的重要屏障之一,是宿主、营养物质和常驻微生物群之间信息交换的接口。免疫系统、神经系统和微生物生态系统之间的动态相互作用维持了正常的肠道生理和组织完整性【1】。免疫系统和神经系统都具有非常特殊的感知和效应能力,两者如何结合起来感知GI的化学、破坏性或传染性威胁是一个极具吸引力的课题。
胃肠道受到感觉神经元和自主神经元组成的复杂网络密集地支配,支配肠道的神经元包括肠道神经系统(ENS),这是一个在很大程度上自主的内在系统,它协调肠道的运动和分泌功能。此外,来自背根神经节(DRG)和结状神经节(NG)的外在感觉神经元,以及位于脑干和交感神经节的自主神经细胞,都会向肠道投射,调节ENS的活动。DRG和NG神经元主要作为感觉神经元发挥作用,它们拥有多种受体,用于检测机械拉伸、饮食和有害刺激【2, 3】。
研究表明,肠道神经支配神经元群体是高度多样化,同样复杂的还有肠道免疫系统,包含了几乎所有谱系的免疫细胞。在这一领域,一些精心设计的研究已经针对特定的神经或免疫亚型,并揭示了特定的神经-免疫相互作用,但大多数都是一对一的相互作用,目前还需要一种更系统且综合的方法来识别肠道中特定的神经-免疫相互作用。
近日,来自美国哈佛医学院的Isaac M. Chiu团队于Science上在线发表题为A chemogenetic screen reveals that Trpv1-expressing neurons control regulatory T cells in the gut的文章,利用交叉的化学遗传学方法来确定不同的神经元是如何调节肠道免疫系统。通过激活八种不同的神经元亚群,并通过深度免疫表型分析、微生物组分析以及肠道器官中免疫细胞的转录组学来评估这些激活的效果,发现不同类型的神经元对不同的免疫细胞群体有特定的调节作用,其中表达Trpv1的痛觉感受器神经元引起了最广泛的免疫调节,其可通过释放神经肽降钙素基因相关肽(CGRP)对调节性T细胞(Treg细胞)的数量产生影响,以此为理解疼痛与肠道免疫之间的联系提供了新的视角。

化学遗传学方法提供了激活或抑制分子定义的神经元的潜力,并且允许同时探测许多这样的神经元类型。该方法基于DREADD(由设计药物独特激活的设计受体)的靶向表达,DREADD是工程化的G蛋白偶联受体(GPCR),在没有合成配体激活的情况下是无活性的,而这种合成配体在哺乳动物中没有对应的配体或受体。因此,神经元可以以时间控制的方式被激活。如果作为细胞类型特异性转基因表达或通过具有良好趋向性的病毒载体传递,它们还允许空间和解剖学上的靶向。例如,化学遗传学已经用于识别进食和其他行为的神经基础。
本文研究人员建立了一个基于DREADD分子靶向表达的系统性筛选,以检测外周神经元亚型的激活如何调节免疫系统和肠道微生物组。其总体策略是通过腺相关病毒(AAV)载体转导处于非活动状态的DREADD编码序列,该序列被特定神经元亚型中表达的Cre重组酶解除阻断,最后通过注射DREADD配体来激活这些靶向神经元(图1A)。
研究人员选择将高滴度的AAV病毒原液注射于新生小鼠,因为与成年小鼠相比,新生小鼠的神经元标记水平更高,且避免了近期病毒感染引起的免疫混淆。对于神经元靶向,研究人员选择了一组8个转基因小鼠系,在支配肠道的外周感觉和自主神经元的主要亚群中表达Cre。同时,根据已发表的单细胞RNA测序(scRNA-seq)数据集以及定义明确的肠道神经支配神经元的经典标记物,选择了以下驱动基因:Chat、Nos1、Vip、Tac1、Trpv1、Mrgprd、Th和Piezo2(图1B)。初步实验证实,这种交叉化学遗传学方法将DREADD表达限制在特定的神经元类别中,并且在这些类别中占相当大的比例,从而允许研究者更精确地研究这些特定神经元群体的功能和它们在生理或病理过程中的作用。
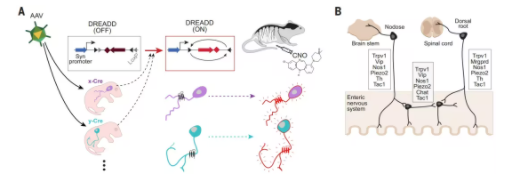
图1 实验程序示意图(A)以及不同解剖位置(NG、DRG和ENS)支配肠道的神经元亚型和每个位置表达的标记物(B)(Credit: Science)
随后,研究人员研究了各种神经元的化学遗传学激活所引起的肠道内免疫细胞群的变化。结果检测到几种神经免疫关系,其中神经元亚群的激活导致免疫表型的明显变化,且有些关系是位置特异性的。同时,在肠道神经支配的不同来源中(NG、DRG或ENS)发现了对免疫细胞群有影响的神经元类型,揭示了由化学遗传学激活不同神经元类型所引起的一系列离散的变化,其中,表达Trpv1的痛觉感受器神经元具有最广泛的影响。然而,研究人员发现,广泛的肠道神经元类型的激活并没有引起肠道菌群的大规模重组,只是引起了门类代表性的适度变化。因此,研究人员将后续的研究重点聚焦在了Trpv1+神经元激活后引起RORg+ Treg细胞的频率显著下降上。
RORγ+ Treg细胞部分来源于肠道淋巴组织中FoxP3阴性的常规T细胞(Tconv)的转化,但关于这种转化是发生在引流淋巴结还是发生在固有层,目前还存在一些争议。本研究的实验结果显示,Trpv1+神经元的激活在固有层中是可见的,但在肠系膜淋巴结(mLN)中则不是,正如Treg细胞总数的减少一样,表明神经元激活影响了肠壁中的免疫细胞,而不影响引流淋巴结中的细胞。进一步地探索Trpv1+神经元激活和RORg+ Treg细胞之间的联系机制发现,痛觉感受器的激活通过减少准备进入细胞周期的Treg细胞的比例,从而减小了RORγ+ Treg细胞的储备。分别用葡聚糖硫酸钠(DSS)和鼠柠檬酸杆菌(Citrobacter rodentium,一种附着性和消隐性细菌病原体)诱导小鼠结肠炎,不论是急性还是慢性炎症模型都证实,Trpv1+神经元激活导致RORg+ Treg细胞水平降低,改变了肠道炎症反应,使肠道对DSS和柠檬酸杆菌的攻击更敏感。
进一步地对肠道生态系统进行探索,研究人员发现,Trpv1+神经元激活不会对结肠的免疫或神经结构产生重大影响。那么Trpv1+神经元激活和RORg+Treg细胞变化之间发生了什么中间事件呢?研究人员对小鼠盲肠的总CD45+免疫细胞进行了scRNA-seq,发现Trpv1+神经元激活小鼠的一些免疫细胞发生了变化,其中淋巴细胞变化最为明显,髓细胞变化较少。对单个细胞群体进行差异基因表达分析显示,Trpv1+神经元激活对不同免疫细胞类型的基因表达有轻微但广泛的影响。此外,研究结果显示Treg细胞中感觉神经元激活的特征在正常的RORg+ Treg细胞中就预先存在,提示在未受干扰的正常小鼠中,神经元与Treg细胞之间的交流已经可以在生理刺激下发挥作用了。
与此同时,研究人员又探索了导致Treg细胞调节的神经元机制,发现激活DRG中的感觉性Trpv1+神经元,而不是迷走神经神经元,足以引起胃肠道中Treg细胞群的变化。在反复激活痛觉感受器的情况下,脊髓DRG的Trpv1+神经元,而不是迷走神经神经元,在调节RORγ+ Treg细胞中发挥了关键作用。DRG中的Trpv1+神经元是肽能的,可表达包括降钙素基因相关肽(CGRP)和P物质(SP)在内的神经肽。研究人员发现,Trpv1+神经元向Treg细胞发出信号并不需要SP和神经激肽,而是由Trpv1+神经元在化学遗传学激活下释放的CGRPα与RORγ+ Treg细胞上的RAMP1-CALCRL受体复合物结合,并对其产生了负向调节作用,尽管CGRP本身并没有影响Treg细胞储备的长期稳定性。
综上所述,本研究使用了一个基于DREADD的体内神经元激活系统,发现了一系列控制和调节肠道免疫细胞群的神经免疫相互作用,并证明了Trpv1+神经元通过CGRP-Ramp1信号通路调节肠道Treg细胞的作用,从而展示了一个有趣的可能性——神经系统和免疫系统,尽管它们在分子层面上的感觉模式不同,但它们可能协同工作,以实现对消化道潜在有害挑战的平衡反应。

