图片来自Cell, 2024, doi:10.1016/j.cell.2024.08.024
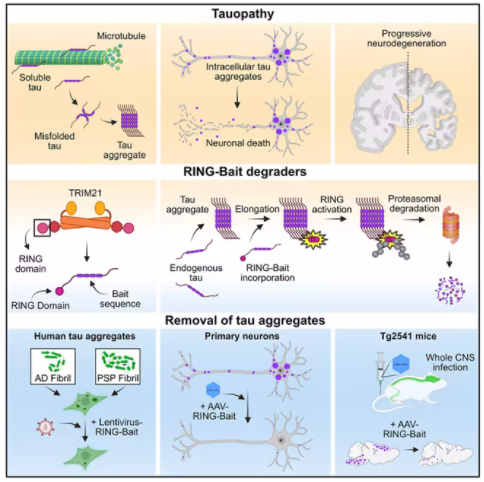
2023年,同一研究团队证实TRIM21可以重新用于破坏与阿尔茨海默病相关的tau蛋白聚集物(Science, 2023, doi:10.1126/science.abn1366)。通过将结合病毒的抗体换成结合tau的抗体,TRIM21被重新定向,将tau聚集物送往蛋白酶体进行破坏。TRIM21特别适用于这一目的,因为其“RING”部分只有在两个或两个以上的TRIM21蛋白质聚集在一起时才会被激活。这意味着,只有当TRIM21蛋白与相邻的tau蛋白聚集物结合时,它才会激活并标记其靶标用于随后的破坏。
新的特洛伊木马疗法
在这两篇论文中,研究者利用TRIM21创造了两种针对tau聚集物的新疗法。第一种疗法是“RING-纳米抗体(RING-nanobody)”,它将结合tau蛋白的纳米抗体与TRIM21 RING结合在一起。第二种疗法是“RING-诱饵(RING-Bait)”,它将TRIM21 RING与tau蛋白本身的一个拷贝连接在一起。与TRIM21 RING连接的tau蛋白像诱饵一样,tau蛋白聚集物会将其纳入其中,TRIM21 RING也会被纳入其中。一旦在tau蛋白聚集物中加入多个RING-Bait,它们就会被激活,导致整个聚集物被破坏。
研究者将编码这两种TRIM21疗法的DNA递送到含有tau聚集物的细胞中,发现这能清除tau缠结,而“健康”的tau蛋白没有被破坏。剑桥大学英国痴呆症研究所的Will McEwan博士说:“tau聚集物藏在脑细胞内,很难降解。重要的是,这些基于TRIM21的新疗法可以直接在细胞内施用,大部分tau聚集物就在细胞内。我们找到不仅能降解tau聚集物还能让健康的tau完好无损地发挥作用的方法。这种新策略超越了目前正在进行临床试验的反义寡核苷酸疗法,因为它可以避免消除正常tau可能产生的任何长期副作用。”
临床前研究结果
研究者在由阿尔茨海默病或进行性核上性麻痹患者捐献的脑组织中含有tau蛋白聚集物的细胞上测试了这两种疗法。结果显示,RING-Bait疗法能够防止来自阿尔茨海默病和进行性核上性麻痹患者大脑中的蛋白诱导的tau聚集。MRC分子生物学实验室的Leo James博士说:“神经退行性疾病的tau蛋白会以多种不同的方式发生错误折叠,因此每种疾病都可能需要不同的治疗方法。RING-Bait的一个有用之处在于,因为它附着在tau蛋白上,所以它是一个通用的特洛伊木马,应该像细胞自身错误折叠的tau蛋白一样,被整合到不同类型的tau聚集物中。”
小鼠实验结果——运动功能明显改善
为了使这种治疗在动物体内发挥作用,研究者使用了一种无害的病毒,即腺相关病毒(AAV),递送DNA指令,在脑细胞内制造定制的蛋白质。对携带tau蛋白聚集物的老年小鼠注射单剂量的AAV载体,几周内,接受治疗的动物脑细胞中聚集的tau数量明显减少。重要的是,接受RING-Bait治疗的小鼠的神经退行性症状进展减缓,运动功能明显改善,这是由人工智能程序对小鼠的奔跑能力进行评估得出的结果。
Lauren Miller博士说:“我们之前并不知道专门清除细胞内的tau聚集物是否足以阻止疾病的进展。令人鼓舞的是,在我们的模型系统中,RING-Bait方法降低了疾病的严重程度,这表明选择性清除tau聚集物是一种有效的治疗方法。还需要进一步的研究来证明这种有益效果在多种人类疾病模型中都能实现。”
未来展望
MRC分子生物学实验室的Guido Papa博士说:“RING-Bait的优点在于它具有广泛的适应性,并有可能解决以病理蛋白簇积累为特征的其他疾病。其他神经退行性疾病是由其他蛋白形成的聚集物引起的,如运动神经元疾病中的TDP43和帕金森病中的α-突触核蛋白。我们希望,RING-Bait未来能够开发出直接针对这些疾病聚集过程的疗法。”
研究者告诫说,这些疗法在开展人体临床试验之前仍需要大量的开发工作,尤其是开发一种AAV载体,能够安全有效地将RING-nanobody或RING-bait疗法递送到整个人脑的细胞中。剑桥大学英国痴呆症研究所的Jonathan Benn博士说:“尽管我们在小鼠模型中证明了它的有效性,但这离可用于人类的疗法还有很长的路要走。我们需要确定在人脑中使用基于TRIM21的疗法是否安全,以及这类疗法是否能有效清除聚集物和改善病程。一些AAV载体已被批准用于人类,如退行性眼病和脊髓性肌肉萎缩症等遗传疾病。然而,要将足够的AAV植入成人大脑仍是一项重大挑战,人脑比小鼠大脑大1000倍。但这是一个快速发展的领域,我们希望未来能有最先进的基因递送方法来大规模递送我们的疗法。”