隐孢子虫病(cryptosporidiosis)是由一种很难消灭的寄生虫——隐孢子虫(Cryptosporidium)引起的。隐孢子虫病严重影响五岁以下营养不良的儿童,而且往往是致命的,因此成为全球儿童死亡的主要原因之一。现有的唯一药物硝唑尼特(nitazoxanide)对免疫力低下的患者和营养不良的儿童的批准和疗效有限。由于没有疫苗可用,没有可靠有效的治疗方法,每年有数十万人的生命受到威胁,因此迫切需要新的治疗方法。
隐孢子虫寄生在小肠上皮细胞的一个胞内胞质外的纳虫空泡(parasitophorous vacuole)中。从本质上讲,这种寄生虫用肠壁细胞组织做成一个小茧,并在茧内形成一个次级保护壳。这种独特的构造使药物靶向成为一项挑战。有效的治疗必须同时穿透肠道细胞膜和这种次级保护壳才能到达隐孢子虫的内部。

题为“Cryptosporidium lysyl-tRNA synthetase inhibitors define the interplay between solubility and permeability required to achieve efficacy”。
作者的研究重点是抑制赖氨酰-tRNA 合成酶(lysyl-tRNA synthetase, KRS),即一种对隐孢子虫生存至关重要的酶。通过分析各种强效 KRS 抑制剂,他们旨在确定在小鼠感染模型中抑制这种寄生虫所需的最佳理化和药代动力学特性。他们根据化合物的溶解度和渗透性特征筛选出 14 种化合物。
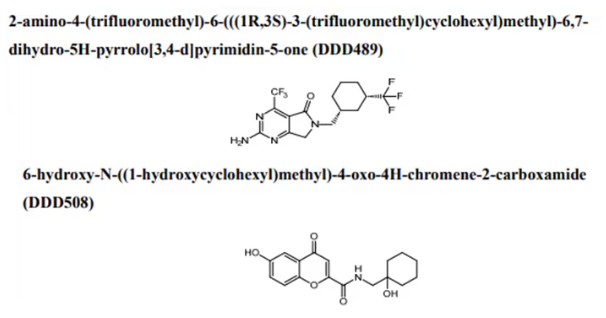
DDD489 和 DDD508的化学结构
溶解度受限或渗透性受限的化合物对隐孢子虫在小鼠体内脱落的减少程度最高。有两种化合物(DDD489 和 DDD508)被确定为最有效的化合物,可减少 99.8% 以上的隐孢子虫,且不会复发。这两种化合物还能减少小牛模型中的隐孢子虫,与对照组相比,接受治疗的小牛腹泻严重程度明显减轻。DDD489 和 DDD508 已被选入临床前安全性研究,以便扩大隐孢子虫病的潜在治疗方案。
这些发现为有效治疗隐孢子虫病所需的理化和药代动力学特性提供了指导。将这些化合物推进临床前安全性研究是开发治疗这种被忽视的传染病的第一步。

