高亲和力抗体生成的浆细胞(PCs)相较于同时期的生发中心(GC)B细胞具有更高的比例(Credit: Science)
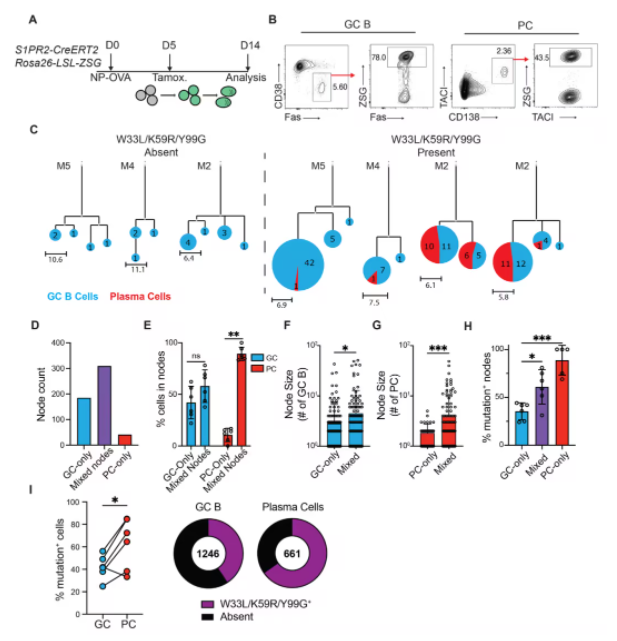
实验设计 (A)
实验采用小鼠模型,通过流式细胞术(flow cytometry)分离膝窝淋巴结(popliteal LN, pLN)中的GC B细胞和浆细胞。GC B细胞的分选标准为:活细胞(live)、TACI-、CD138-、B220+、CD38-、Fas+ 和ZSG+;浆细胞的分选标准为:活细胞(live)、CD138+、TACI+ 和ZSG+。
B细胞和浆细胞的克隆分布 (B, C)
研究通过单细胞IgH和IgL序列分析绘制了GC B细胞(蓝色)和浆细胞(红色)的系统发育树。结果显示,具有亲和力增强突变的扩展克隆(右图)在浆细胞中比例较高,而没有此类突变的克隆(左图)则分布较为随机。
克隆分类统计 (D)
克隆被分为三类:仅包含GC B细胞的克隆(GC-only),仅包含浆细胞的克隆(PC-only),以及同时包含两种细胞的混合克隆(mixed nodes)。结果显示,仅包含浆细胞的克隆数量最少,而混合克隆的数量最多。
细胞类型的分布频率 (E)
在混合克隆和单一细胞类型克隆中,浆细胞的比例显著高于GC B细胞。数据以每只实验小鼠为单位进行呈现,表明此趋势具有统计学显著性。
克隆节点大小 (F, G)
在GC B细胞和浆细胞的单一或混合克隆中,浆细胞的节点(即细胞数量)更大。这表明浆细胞在克隆扩增中占据主导地位。
亲和力增强突变的分布 (H, I)
突变的克隆频率 (H):含有亲和力增强突变的克隆在浆细胞中比例显著高于GC B细胞。
突变的总频率 (I):相比同时期的GC B细胞,浆细胞群体中携带亲和力增强突变的细胞数量显著增多(p<0.05 或更低)。这一结果表明,浆细胞更倾向于富集高亲和力抗体突变。
浆细胞的崛起:超越生发中心的关键角色
当高亲和力抗体在生发中心内完成初步优化后,这些抗体的最终“精益求精”则离不开浆细胞(Plasma Cell, PC)的关键作用。浆细胞是B细胞的分化产物,专门负责分泌抗体,是体液免疫反应的中坚力量。然而,该研究表明,浆细胞不仅是抗体的生产者,更是抗体亲和力提升的重要推动者。
研究人员通过小鼠模型中的单细胞基因追踪技术发现,在生发中心释放出的浆细胞群体中,高亲和力抗体的比例并未显著高于同时期的B细胞。然而,随着浆细胞在体内的持续分裂和扩增,这一群体逐渐被表达高亲和力抗体的浆细胞主导。这种选择并非依赖于低亲和力浆细胞的死亡,而是通过高亲和力浆细胞更高的分裂速率和克隆扩增实现的。
实验数据进一步揭示了这一机制:研究团队使用标记分裂状态的H2B-mCherry小鼠模型,证明高亲和力浆细胞分裂更快、更频繁。与低亲和力浆细胞相比,高亲和力浆细胞的克隆家族更为庞大,同时抗体的亲和力增强突变比例显著提高。这种亲和力依赖的克隆扩增机制,让浆细胞在短时间内大幅提升了抗体的总体亲和力。
这一机制在多种疫苗抗原(如SARS-CoV-2的受体结合域)中均得到验证。无论抗原种类如何,高亲和力浆细胞均表现出显著的扩增优势,为开发高效疫苗提供了全新的策略。
亲和力依赖的扩增:克隆扩增如何重塑抗体库?
抗体的亲和力提升不仅依赖于生发中心的筛选过程,还受到浆细胞克隆扩增的强大推动力。克隆扩增是一种“优胜劣汰”的免疫机制,它将高亲和力浆细胞在抗体库中占据主导地位,从而显著提高免疫系统的防御能力。
研究人员通过单细胞测序技术和标记分裂状态的小鼠模型发现,浆细胞的扩增并非随机发生,而是高度依赖于抗体的亲和力。标记分裂程度的H2B-mCherry小鼠中,高亲和力浆细胞的分裂数量显著高于低亲和力浆细胞,后者的分裂更为缓慢甚至停滞。这种差异化的分裂模式是抗体库优化的重要动力。
而且,高亲和力浆细胞的克隆扩增并不依赖于持续的生发中心输出或T细胞帮助。在抗原刺激后的一段时间内,即使通过阻断CD40L信号中断了生发中心反应,高亲和力浆细胞仍然能够在淋巴结髓质等区域完成扩增。这种“后生发中心”扩增机制,赋予了免疫系统灵活应对病原体变异的能力。
在使用NP-OVA抗原的小鼠模型中,高亲和力抗体的突变比例从生发中心释放时的约42%提升至浆细胞扩增后的63%。这种显著的富集表明,克隆扩增不仅提高了抗体亲和力,还增强了抗体的中和能力。
克隆扩增的意义深远,它是抗体亲和力成熟的重要延续过程,也是免疫系统快速适应病原体挑战的核心机制。
疫苗研发中的启示:如何激发更强大的免疫应答?
疫苗的核心目标是激发免疫系统生成高效抗体,从而对抗病原体。然而,不同疫苗的保护效果和持续时间差异显著,原因之一就在于抗体亲和力的成熟程度。该研究发现,为提升抗体亲和力,优化浆细胞的扩增机制和生发中心的反应过程可能是疫苗设计的关键方向。
研究指出,高亲和力浆细胞的克隆扩增是抗体亲和力提升的核心驱动力。这一发现为疫苗设计提供了新思路:通过优化抗原和佐剂的配方,增强浆细胞的分裂与扩增速率,从而提升免疫应答的效力。例如,研究人员通过使用不同的疫苗抗原(如SARS-CoV-2受体结合域和破伤风毒素抗原),观察到高亲和力浆细胞在抗原刺激后的显著扩增。这表明,设计能够高效激活浆细胞扩增的抗原,是提高疫苗效力的重要策略。
此外,抗体亲和力的成熟过程还依赖于T细胞辅助信号的强度和时长。研究发现,通过短时强化生发中心的T细胞信号,可以显著提升高亲和力B细胞和浆细胞的比例。这一机制提示疫苗开发者,可以通过精准调控佐剂的免疫刺激时间窗,以最大化免疫效应。例如,调节IL-21等细胞因子的水平,已被证明可以促进浆细胞的扩增和抗体亲和力的进一步优化。
另一个启示是,针对不同病原体的疫苗设计应注重抗体库的多样性。生发中心的循环选择和浆细胞的扩增不仅提升了抗体亲和力,还保留了足够的抗体多样性,以应对病原体的变异。这一特点对于高变异性病毒(如流感和新冠病毒)尤为重要。
解码免疫系统的奥秘
免疫系统的复杂性犹如一座待解的迷宫,而抗体亲和力成熟研究的突破正在为这一领域注入新的活力。这些发现不仅揭示了浆细胞在亲和力提升中的关键作用,也为理解免疫系统的动态调控机制开辟了全新的视角。那么,未来这一研究方向将如何发展?它又会对医学领域产生怎样的深远影响?
首先,关于浆细胞扩增的精确调控机制仍有许多未解之谜。尽管现有研究揭示了高亲和力浆细胞的扩增依赖于抗体亲和力和特定的信号通路(如Myc和IL-21信号),但在不同病原体和免疫环境下,这些机制是否存在变异尚待进一步探讨。此外,长寿浆细胞如何在骨髓等免疫隐匿部位维持长期抗体分泌的能力,也是未来研究的重点。深入了解这些过程或将为慢性疾病的免疫疗法提供突破性思路。
其次,研究成果正在推动疫苗设计进入个性化和精准化时代。通过模拟浆细胞扩增和抗体优化的机制,研究人员可以开发针对不同病原体和个体免疫差异的“智能疫苗”。例如,对于高变异性病毒(如流感和新冠病毒),研究抗体库多样性与亲和力之间的平衡,或许能实现对多种病毒变种的广谱保护。
此外,抗体亲和力研究还可能催生全新的治疗性抗体开发策略。通过人工筛选和扩增高亲和力抗体,结合基因编辑技术优化抗体结构,未来的治疗性抗体可能具备更强的中和能力和更广的适用范围,这对于癌症免疫疗法和自身免疫疾病的治疗尤为重要。
最后,这一研究领域的探索也将为人类免疫学的整体认知带来深远影响。从抗体生成机制到免疫记忆的维持,研究人员正在逐步拼凑免疫系统的完整图景。这不仅有助于提升人类应对传染病的能力,更可能彻底改变对免疫健康的管理方式。