吗啡、芬太尼、美沙酮等阿片类药物是临床上常用的强效镇痛药,通过激活体内的阿片受体来缓解疼痛。这类药物容易导致成瘾、耐受和呼吸抑制等副作用,限制了其长期使用。
近日,美国加利福尼亚大学分校Sakeen W. Kashem、Allan I. Basbaum 等人发表在顶刊《科学》的最新论文提出,雌性小鼠体内竟有一群免疫细胞兼职干着生产阿片类药物的活儿。
研究团队发现,在神经损伤时,定居于中枢神经系统边界组织的调节性T细胞能够分泌一种内源性阿片肽——脑啡肽,通过选择性激活周围感觉神经元上的阿片受体,显著抑制机械性痛觉超敏。这一镇痛通路仅在雌性小鼠中发挥作用,由雌激素和孕激素协同驱动,且独立于调节性T细胞的免疫调节功能。

论文首页截图
说到调节性T细胞(Treg细胞),我们都知道它隶属于免疫系统,调节免疫反应。比如分泌抑制性细胞因子IL-10、TGF-β维持免疫稳态,防止自身免疫反应并调节炎症修复。在肿瘤微环境中,Treg细胞则发挥双重作用,既能抑制过度免疫激活,又可能促进肿瘤免疫逃逸,成为癌症治疗的障碍。
而在这项研究中,研究团队揭示了Treg细胞不为人知的另一面——除了参与免疫调节,它还直接调控着痛觉感知。
他们首先聚焦于Treg细胞在中枢神经系统(CNS)中的分布特征。通过荧光标记和三维成像技术,研究团队观察到Treg细胞在小鼠脊髓脑膜和包裹背根神经节(DRG,属于周围神经系统[PNS])的软脑膜富集,且与非肽能感觉神经元纤维密切相邻,他们将其称为mTreg细胞。
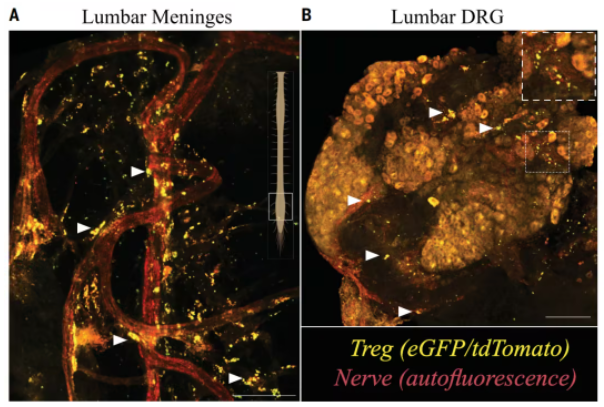
发现mTreg细胞
尽管不同性别小鼠的mTreg细胞数量相近,但通过基因编辑特异性清除小鼠的mTreg细胞,研究者们发现,仅雌性小鼠在mTreg细胞被清除后对机械痛觉的敏感度提高,不过不改变对冷热等感觉刺激的反应;然而,雄性小鼠的疼痛阈值未受到任何影响。这一现象提示,mTreg细胞发挥着镇痛功能,且具有明显的选择性,挑疼痛类型,也挑性别。
为了解mTreg细胞为何区别对待男女鼠鼠,研究团队利用“四核心基因型”(FCG)小鼠模型,将性腺类型(卵巢或睾丸)与性染色体(XX或XY)解耦分析。
结果显示,无论性染色体组成如何,只要性腺为卵巢的个体(即生理上的雌性),均表现出mTreg细胞依赖的痛觉抑制;而性腺为睾丸的个体(雄性)则无此现象。通过卵巢切除实验和激素替代治疗,研究团队锁定雌激素与孕酮的协同作用是调控mTreg细胞功能的关键,阻断雌激素受体或同时缺乏两种激素会完全消除mTreg细胞的镇痛效应。
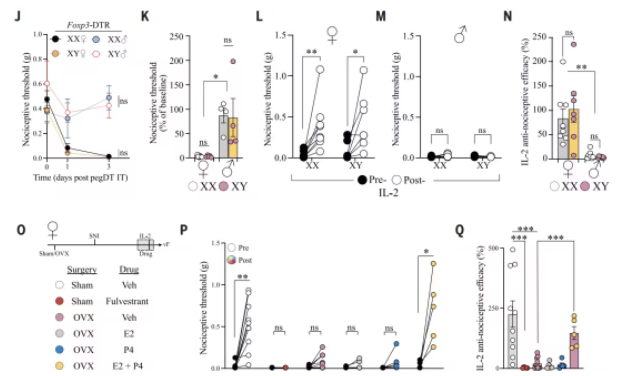
介导性别差异的不是性染色体,而是激素
接下来,研究转向分子机制探索。
通过对mTreg细胞的转录组分析和小鼠实验,研究团队发现活化的mTreg细胞高表达编码脑啡肽前体的基因Penk,脑膜区域脑啡肽主要来源于mTreg细胞,且雌性小鼠中表达Penk的mTreg细胞数量显著高于雄性。
当通过骨髓嵌合技术特异性敲除造血系统来源的Penk基因后,雌性小鼠的机械痛阈显著降低;而直接向神经损伤模型(SNI)小鼠鞘内注射低剂量IL-2以扩增mTreg细胞,则可逆转痛觉超敏。这些效应均严格依赖于雌激素和孕激素的存在。
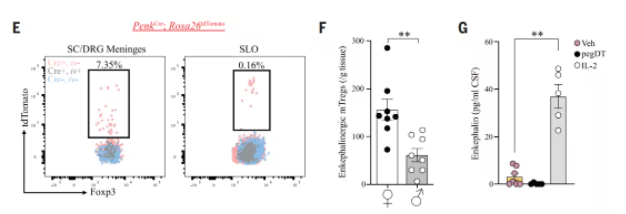
mTreg细胞表达脑啡肽
脑啡肽是一种内源性阿片肽,mTreg细胞作为免疫系统的工作者,分泌这个镇痛因子做什么?
为解析脑啡肽的作用靶点,研究团队结合特异性荧光报告系统、神经元钙成像技术、单细胞RNA测序等技术发现,mTreg细胞分泌的脑啡肽可选择性地激活背根神经节中表达δ阿片受体(δOR)的MrgprD⁺非肽能感觉神经元,从而抑制钙离子通道活性,缓解神经损伤后的机械性疼痛。
这个现象很不同寻常——一群位于中枢神经系统的免疫细胞,竟然可以通过旁分泌直接调控周围神经系统的感觉神经元。
在神经损伤模型中,敲除周围神经系统而不是中枢神经系统的MrgprD⁺神经元上的δOR基因(Oprd1),会完全阻断mTreg细胞的镇痛作用,但不影响热痛或运动功能等感觉模态。
研究还表明,mTreg细胞也不是时时刻刻都在给神经元投喂止痛药的。通过抑制小鼠的δOR,研究团队观察到,mTreg细胞介导的镇痛作用仅在神经损伤后触发,而在生理状态下不激活。
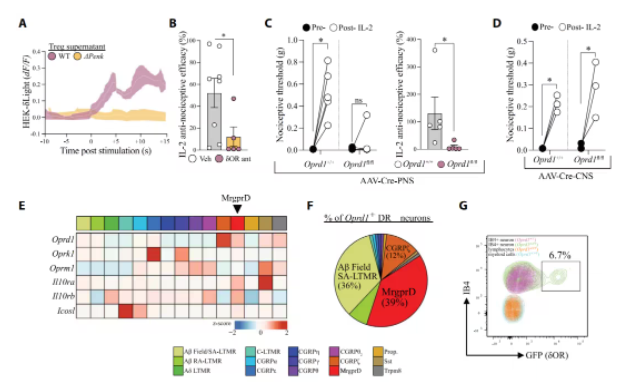
mTreg细胞分泌的脑啡肽作用于表达δOR的感觉神经元
值得注意的是,mTreg细胞的镇痛功能与其经典免疫抑制、组织修复作用无关。Penk缺陷型Treg细胞照样能够抑制CD4+常规T细胞的增殖,并在移植物抗宿主病小鼠模型中有效缓解炎症反应。这表明,mTreg细胞通过脑啡肽-δOR通路调控痛觉是一种独立于免疫稳态的“专职化”功能。
总体来说,该研究揭示了一种由脑膜调节性T细胞介导的性别特异性疼痛调控新机制。
可能很多读者朋友在想,这是否能解释男女对疼痛感受的差异?其实,这篇论文确实是为理解疼痛的性别差异提供了分子机制层面的解释,但其重点在于找到了雌性小鼠专属的镇痛系统,并没有证明多了这套系统就比雄性小鼠更“耐痛”,研究者们也表示未来需要继续探索雄性体内的专属镇痛方式。
不过,这项研究结果倒是可以解释为何绝经后的女性会感受到更多疼痛,因为mTreg细胞镇痛功能的启动需要激素;另外,细化了解mTreg细胞的镇痛机制,可以拓展我们对内源性镇痛系统的认知,为治疗慢性疼痛提供新的靶点。




