在妇科肿瘤领域,卵巢癌一直是一个棘手的难题。多数卵巢癌患者确诊时已处于晚期,现有的治疗手段,像手术、化疗以及PARP抑制剂等靶向疗法,虽在一定程度上能控制病情,但患者5年生存率仍低于50%。而且,肿瘤耐药问题频发,这让寻找更有效的治疗方法成为医学研究的迫切需求。
近日,发表于Cancer Lett的一项研究A Necrosis Inducer Promotes an Immunogenic Response and Destroys Ovarian Cancers in Mouse Xenografts and Patient Ascites Organoids,为卵巢癌治疗带来了新的曙光。

该研究聚焦于一种名为ErSO的化合物,它是一种预期性未折叠蛋白反应(a-UPR)的超激活剂。此前,研究人员发现它在乳腺癌小鼠模型中能显著抑制肿瘤生长。此次,研究团队想探究它对卵巢癌是否同样有效。
研究人员先在体外对人PEO4和Caov-3卵巢癌细胞进行实验。结果显示,PARP抑制剂奥拉帕利(Olaparib)对这两种癌细胞的增殖影响微乎其微,而ErSO却能高效杀死癌细胞。在4天的剂量反应研究中,100nM的ErSO几乎能完全抑制癌细胞增殖,250nM的ErSO则可杀死大部分癌细胞。24小时内,500nM的ErSO能使约一半的PEO4细胞和约40%的Caov-3细胞死亡。

图 1:ErSO在体外杀死人类卵巢癌细胞
接着,研究人员建立了原位小鼠卵巢癌异种移植模型。他们将表达荧光素酶的PEO4和Caov-3细胞分别移植到免疫缺陷的NSG小鼠卵巢中,通过生物发光成像技术观察肿瘤生长和消退情况。结果令人振奋:用40mg/kg的ErSO腹腔注射治疗,PEO4肿瘤在3天内消退超过98.5%,14天时几乎检测不到;Caov-3肿瘤在注射3天后,所有小鼠的肿瘤都完全消退,且在7天和14天时仍检测不到。口服ErSO虽效果稍逊,但也能显著抑制肿瘤生长。而且,对口服ErSO治疗后复发的肿瘤,再次用注射ErSO治疗,依然有效,这表明肿瘤并未对ErSO产生耐药性。
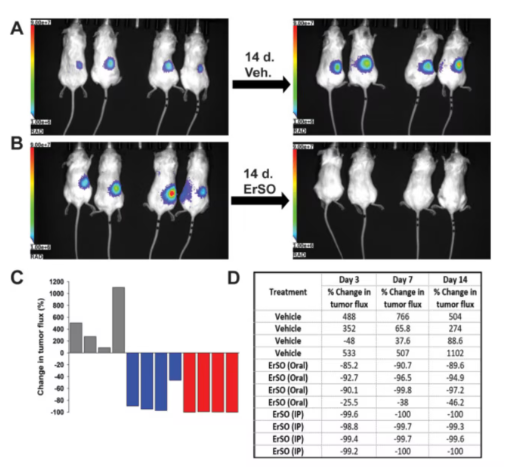
图 2:ErSO在小鼠异种移植模型中破坏原发性和转移性PEO4卵巢肿瘤

图 3:注射ErSO根除Caov-3卵巢肿瘤
卵巢癌患者的恶性腹水中含有癌细胞类器官,这些类器官具有干细胞特性,是肿瘤转移的重要因素,且难以被传统疗法靶向。研究人员获取了7名患者的腹水,分离出其中的类器官(PDAOs)进行实验。结果发现,ErSO对所有7个新鲜的PDAOs都有抑制作用,低纳摩尔浓度的ErSO就能完全破坏其中2个PDAOs。不同患者的PDAOs对ErSO的反应存在差异,部分在250nM ErSO作用下,荧光下降40-60%,还有两个晚期患者的PDAOs在50nM ErSO时就几乎完全反应。

图 4:ErSO对新鲜的卵巢癌患者来源的腹水类器官(PDAOs)有效
深入研究发现,ErSO诱导癌细胞死亡的机制是通过超激活a-UPR。它能激活UPR的PERK-eIF2α通路,抑制蛋白质合成,耗尽细胞内ATP。同时,ErSO还能诱导细胞坏死,而非凋亡或坏死性凋亡,这一过程会释放损伤相关分子模式(DAMPs),比如HMGB1。释放的HMGB1可激活人体巨噬细胞,诱导单核细胞迁移,增强免疫细胞对癌细胞的攻击能力。

图 5:ErSO处理的卵巢癌细胞的培养基激活人类免疫细胞
总的来说,这项研究表明,ErSO这种a-UPR超激活剂在多种卵巢癌模型中展现出强大的抗癌效果,它不仅能直接杀死癌细胞,还能激活免疫细胞,引发免疫原性细胞死亡。而且,通过检测患者腹水类器官对ErSO的敏感性,有望实现卵巢癌的个性化治疗,筛选出最能从该疗法中获益的患者。虽然目前这还处于研究阶段,但它为卵巢癌的治疗开辟了新方向,让我们看到了攻克卵巢癌的新希望。未来,期待能有更多相关研究,推动这一成果早日应用于临床,为卵巢癌患者带来更好的治疗选择和生存机会。





