前世今生:核内肌动蛋白网络的“幕后”指挥
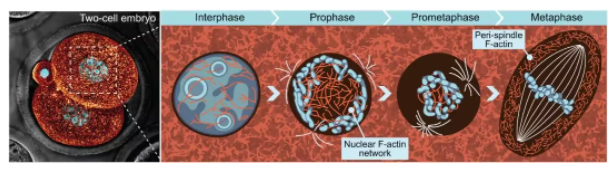
想象一下细胞核(nucleus),它就像细胞的中央情报室,里面存放着至关重要的基因组(genome)蓝图。在有丝分裂前期(prophase),当染色体开始凝集(condensation)时,这项研究利用高分辨率成像技术,首次揭示了在早期小鼠胚胎的细胞核内,存在一个致密、相互连接的肌动蛋白(F-actin)丝网络。这并非一个意外发现,研究人员也在人类胚胎(human embryos)中观察到了类似的核内肌动蛋白丝组织,这表明这种机制可能在哺乳动物早期发育中是保守的(conserved)。
那么,这个核内肌动蛋白网络在有丝分裂的早期阶段究竟扮演了什么角色呢?研究发现,在间期(interphase)和前期(prophase),核内肌动蛋白丝的密度(cable density)在小鼠胚胎中从间期的约0.08 µm/µm³略微增加到前期的约0.09 µm/µm³。而在人类胚胎中,这一密度也从间期的约0.06 µm/µm³增加到前期的约0.08 µm/µm³,表明核内肌动蛋白在前期的确变得更为活跃。
更令人惊奇的是,这个核内肌动蛋白网络与前期的染色体建立了直接的物理相互作用(physical interactions)。而实现这一“联姻”的关键角色,是一种被称为肌球蛋白-10(myosin-10)的肌动蛋白马达(actin motor)。Myosin-10在有丝分裂染色质(mitotic chromatin)上具有特定的定位,它就像一座桥梁,将核内肌动蛋白丝与染色体连接起来。
研究人员通过实验证实了Myosin-10的这一关键作用。当他们通过TRIM-Away方法(一种降解蛋白质的技术)移除内源性Myosin-10,或表达一种缺乏肌动蛋白结合马达域(actin-binding motor domain)的显性负性(dominant-negative)Myosin-10变体(Myosin-10 ΔHL)时,观察到了显著的缺陷。正常情况下,前期的染色体会被定位在细胞核的周边(nuclear periphery),这被认为有助于在核膜破裂(nuclear envelope breakdown, NEBD)后,动粒(kinetochores,染色体上与微管结合的结构)更容易地被微管捕获。然而,在Myosin-10被抑制或耗竭的胚胎中,染色体未能完全定位在核周边。
这种初始定位的失败带来了严重的后果。研究数据显示,在正常情况下,染色体聚合(chromosome congression)完成大约需要80分钟。而Myosin-10被移除或抑制后,这一时间则延迟到了约120分钟甚至更久,这意味着染色体很难及时聚集到中期板(metaphase plate)。更令人担忧的是,染色体分离错误(chromosome missegregation)的发生率也从正常的约10%大幅增加到了约30%,甚至更高。这有力地证明,核内肌动蛋白和Myosin-10共同组织前期染色体在核周边的位置,对于保障有丝分裂的保真度至关重要。
特别值得指出的是,这项研究还发现,Myosin-10的干扰并没有影响染色体在核膜破裂后的向心运动(centripetal movement)。这提示我们,Myosin-10的作用主要在于核膜破裂之前的染色体前期定位,而核膜破裂后的收缩运动则可能由不同的机制驱动。
颠覆认知:收缩力量的“另类”来源
核膜破裂(NEBD)是细胞进入有丝分裂中期(metaphase)的关键一步,此时染色体被释放到细胞质(cytoplasm)中。在传统的观点中,微管会迅速地捕获染色体,并将其拉向细胞中央。然而,在早期小鼠胚胎中,由于缺乏中心体,纺锤体组装过程是高度无序的,因此微管在核膜破裂后并不能立即有效地组织染色体。
这项研究的重大发现之一,正是揭示了在核膜破裂后,核内肌动蛋白网络会迅速收缩(contracts),将染色体向细胞中心聚集。研究人员通过追踪网络节点(network nodes)的坐标,观察到这些节点在核膜破裂后,从距离细胞中心约6微米的位置逐渐向中心移动,最终距离仅约2微米,网络区域面积也从约270平方微米缩小到约170平方微米。这表明该网络处于收缩应力(contractile stress)之下。
更令人惊讶的是,这种收缩并非由我们通常认为的、在肌动蛋白收缩中扮演核心角色的非肌细胞肌球蛋白II(nonmuscle myosin II)驱动。研究人员使用肌球蛋白II抑制剂Blebbistatin处理胚胎后,染色体的向心运动和有丝分裂保真度并未受到影响,这与正常对照组的数据相似。这完全颠覆了我们对细胞内收缩机制的传统认知!
那么,如果不是肌球蛋白II,是什么提供了这种收缩力呢?研究发现,肌动蛋白丝的解聚(filament disassembly)才是驱动这一收缩过程的“另类”力量。当研究人员使用Jasplakinolide(一种防止肌动蛋白解聚的药物)处理胚胎时,染色体向心运动明显受损,染色体聚合延迟,有丝分裂时间延长,染色体分离错误率也从对照组的约10%大幅增加到约40%。相反,当他们使用Latrunculin A(一种通过隔离肌动蛋白单体(monomers)来增强肌动蛋白解聚的药物)处理胚胎时,染色体向心运动的速度反而加快了,染色体散射体积(chromosomal scattering volume)从正常情况的约4.5 x 10³ µm³显著降低到约2 x 10³ µm³。这些数据强烈支持了肌动蛋白解聚驱动网络收缩的机制。
为了进一步揭示这一机制,研究人员还发现,可扩散的交联蛋白(cross-linker)Anillin对于网络收缩至关重要。Anillin能够增强无序肌动蛋白网络的解聚驱动收缩,其在细胞核内的富集也提示了Anillin可能介导了这种网络收缩。
此外,研究还深入探究了肌动蛋白网络组装/解聚的调控。他们发现,Formin-2和mDia2(一类肌动蛋白成核蛋白,actin nucleators)在间期细胞核内高度富集,但在核膜破裂后,它们在核内的浓度迅速降低。这提示这些Formin蛋白可能在间期促进了核内肌动蛋白的组装,而它们在核膜破裂后的稀释则可能降低了肌动蛋白丝的延伸速度,从而促进了丝的解聚和网络的收缩。当使用Formin抑制剂SMIFH2处理胚胎时,核内肌动蛋白密度降低,但核膜破裂后却出现了染色体“超收缩”(hypercontraction)的现象,染色体散射体积甚至比正常情况更小,仅约2 x 10³ µm³。这可能意味着Formin在正常情况下,反而对解聚驱动的收缩起到了一定的“缓冲”作用。
那么,染色体是如何与这个收缩的网络“绑定”的呢?研究人员测量了肌动蛋白网络的孔隙大小(pore size),发现其平均面积约为0.665 µm²,这远小于中期染色体自身的横截面积(约8.07 µm²)。这暗示了一个巧妙的“空间陷阱”(steric trapping)机制:小尺寸的孔隙使得染色体难以逃逸,从而在没有特定马达蛋白的帮助下,也能通过物理限制被动地与收缩网络耦合。
总之,在有丝分裂的早期阶段,早期胚胎的核内肌动蛋白网络就像一个由解聚力驱动的“智能绳索”,在微管纺锤体尚未完全组装之前,就已经高效地将染色体向细胞中心聚集,为后续的精确分离奠定了基础。
肌动蛋白丝组织染色体和微管(Credit: Science)
限制边界:周纺锤体肌动蛋白的“守护”
在前期的“幕后指挥”完成后,细胞进入中期(metaphase),此时微管纺锤体已经初步组装,染色体排列在中期板上。然而,对于缺乏中心体的早期胚胎来说,如何精确控制纺锤体的大小和形态,避免其过度伸长或变形,仍然是一个未解之谜。在体细胞中,中心体和星射线微管(astral microtubules)通常扮演着调节纺锤体大小的关键角色,但早期小鼠胚胎的无中心体纺锤体并不具备星射线微管。
这项研究又揭示了一个令人兴奋的发现:在有丝分裂中期,细胞中央会组装起一个独特的肌动蛋白网络,它围绕并包裹着中期纺锤体。与核内肌动蛋白的缆绳状形态不同,这个被称为“周纺锤体肌动蛋白”(perispindle F-actin)的网络呈现出致密、分支状的形态,类似于分支肌动蛋白(branched actin)。
研究人员进一步探究了这种分支肌动蛋白的来源,发现它是由Arp2/3复合物(Arp2/3 complex)介导成核的。Arp3(Arp2/3复合物的一个亚基)在中期纺锤体周边高度富集,这表明Arp2/3复合物在此区域非常活跃。此外,他们还发现,染色体来源的RanGTP(Guanosine Triphosphate-bound Ran)梯度可以促进Arp2/3复合物的激活,从而驱动周纺锤体肌动蛋白的形成。这就像一个智能信号,告知细胞在纺锤体周围建立起一个“防御圈”。
那么,这个周纺锤体肌动蛋白网络究竟有什么功能呢?研究表明,它就像纺锤体的“守护者”,限制了纺锤体的过度伸长。当研究人员使用Arp2/3复合物抑制剂CK-666处理胚胎时,中期纺锤体出现了明显的“过度生长”(overgrowth),其长度从正常情况的约35微米增加到约40微米。同时,纺锤体的纵横比(aspect ratio)从约3.5下降到约2.5,这意味着其失去了典型的“桶状”形态,变得更长更细。这暗示周纺锤体肌动蛋白像一个物理屏障(physical barrier),抑制了微管的过度延伸。
有趣的是,当研究人员通过过表达膜锚定型(membrane-anchored)的Arp2/3复合物激活剂Memb-VCA时,也观察到了纺锤体的过度伸长和纵横比的下降。这看似矛盾,但实际上,Memb-VCA的过表达会“劫持”和隔离Arp2/3复合物的组分,导致周纺锤体肌动蛋白的有效密度降低,从而达到与抑制Arp2/3复合物相似的效果。这些结果共同证实了周纺锤体肌动蛋白在维持纺锤体大小和形态方面的关键作用。
此外,当研究人员使用Cytochalasin D(一种肌动蛋白解聚剂)处理胚胎时,也观察到了纺锤体的无限伸长和纺锤体极(spindle pole)的碎裂(fragmentation),进一步强调了肌动蛋白对于维持纺锤体长度和形态的重要性。
肌动蛋白,生命的无名英雄
这项开创性的研究彻底改变了我们对早期哺乳动物胚胎有丝分裂机制的理解。它揭示了在这些“无中心体”的细胞中,肌动蛋白 cytoskeleton 以其卓越的灵活性和多功能性,扮演了通常由中心体承担的关键角色,保障了遗传物质的精确分配。
研究人员识别出两种截然不同但功能互补的肌动蛋白组装体:
核内肌动蛋白网络: 在有丝分裂前期,它在Myosin-10的介导下与染色体建立物理连接,将染色体定位在核周边,为后续的微管捕获做好准备。核膜破裂后,该网络通过自身解聚驱动的收缩(而非传统肌球蛋白II驱动),将染色体快速拉向细胞中心。
周纺锤体肌动蛋白网络: 在有丝分裂中期,它在Arp2/3复合物的介导下形成,包裹着纺锤体,并作为物理屏障,精确限制了纺锤体的过度伸长,从而维持其正确的形态。
这些发现不仅解释了早期小鼠胚胎如何在缺乏经典有丝分裂机制的情况下实现高保真度的染色体分离,更凸显了肌动蛋白细胞骨架在生命发育过程中的非凡韧性(remarkable robustness)和适应性。在复杂而多变的细胞环境中,肌动蛋白展现出其作为“无名英雄”的巨大潜力,能够巧妙地弥补其他关键细胞器(如中心体)的不足。
这项研究的意义远不止于细胞生物学领域本身。它为我们理解人类早期胚胎发育中常见的染色体异常(如非整倍体)提供了新的线索。未来,对肌动蛋白在有丝分裂中精确调控机制的深入研究,或许能为我们开发新的诊断工具或干预策略,以解决生殖健康(reproductive health)和先天性疾病(congenital disorders)等问题,最终造福人类。
肌动蛋白,这位细胞内的“隐藏英雄”,正在逐渐揭开其神秘的面纱,向我们展示生命最开始的每一步,都充满了意想不到的智慧与精密。同学们,科学的魅力就在于此,它永远有未知的领域等待我们去探索,永远有颠覆认知的发现等待我们去揭示!让我们一起期待,未来在细胞生物学领域,还会有多少令人激动的新突破!

