Beachy实验室的先前研究表明,膀胱上皮内壁中的干细胞会响应由音猬因子引发的信号级联反应,从而在细菌感染后再生膀胱内壁。他们推测刺刺猬蛋白是否也参与其他上皮组织(如气道)损伤的修复。
当论文第一作者William Kong博士使用一种称为批量RNA测序(bulk RNA sequencing)的技术,在气管细胞中搜索编码刺猬蛋白家族任何成员的遗传信息时,他们检测到沙漠刺猬蛋白的微弱信号,但未检测到其他两个家族成员(即音猬因子和印度刺猬蛋白)的信号。
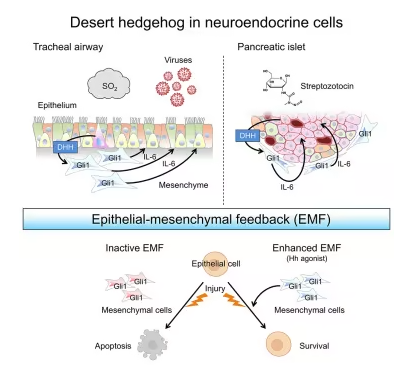
当他们通过基因工程使小鼠体内表达沙漠刺猬蛋白的细胞发出荧光时,他们发现孤立的神经内分泌细胞正在产生沙漠刺猬蛋白。
进一步研究表明,沙漠刺猬蛋白离开上皮层,进入上皮层下方的间质层。在那里,它触发细胞开始产生另一种名为Gli1的蛋白质。当气道细胞感知到损伤时,Gli1诱导一种名为IL-6的蛋白质的表达,该蛋白质触发上皮层中称为基底细胞(basal cell)的干细胞开始分裂并分化以修复损伤。
这种组织层之间的相互作用,研究人员称为上皮-间质反馈(epithelial-mesenchymal feedback),保护并再生肺部上皮中的特化细胞,包括利用羽毛状触手将颗粒和病毒从肺部清除的多纤毛细胞,以及产生粘液以捕获不需要的入侵者的分泌细胞。如果没有这些细胞,病毒和毒素可以更深入地渗透到肺部。
保护性过程
整个过程在毒素暴露后数小时内以协调的级联反应形式发生,最终甚至涉及气道中不表达Gli1的细胞。Beachy说,“在每个阶段,信号都会被放大,直到整个气管受到影响。这种快速反应不仅保护上皮细胞免于死亡,还激活了再生反应。”
阻碍这一保护性信号的后果极为严重。Kong说,“如果这一信号级联过程被破坏,损伤将更加严重。纤毛细胞和分泌细胞会丧失,基底细胞无法分裂。事实上,它们只能尽力伸展以试图覆盖受损区域。”
沙漠刺猬蛋白和Gli1对修复过程至关重要。无法产生沙漠刺猬蛋白或Gli1的小鼠对二氧化硫气体暴露的敏感性显著增强,其中二氧化硫是一种环境污染物,其损伤效果与其他吸入性毒素相似。对照组小鼠在24小时内失去85%的纤毛细胞和41%的分泌细胞,而缺乏沙漠刺猬蛋白或Gli1的小鼠在同一时间内失去96%的纤毛细胞和88%的分泌细胞。
通过小分子激活这个刺猬蛋白信号通路后,二氧化硫暴露后的细胞存活率显著提升:治疗组小鼠中66%的纤毛细胞和82%的分泌细胞存活,而对照组小鼠中仅存活9.7%的纤毛细胞和43%的分泌细胞。
Kong 随后测试了这个刺猬蛋白信号通路激活对感染流感病毒和SARS-CoV-2的小鼠的影响。尽管无法产生Gli的小鼠在感染流感病毒后无法存活超过五天,但所有接受小分子激活剂治疗的小鼠在流感病毒感染后至少存活了八天。感染SARS-CoV-2且无法激活这个刺猬蛋白信号通路的小鼠在气道中出现了大量纤毛细胞的丧失。
最后,研究人员将注意力转向了胰腺,其组织结构与气道相似。他们发现,产生胰岛素的β细胞(一种神经内分泌细胞)也表达沙漠刺猬蛋白,且该器官与IL-6存在相同的上皮-间质反馈环路,以保护这些脆弱的细胞。
研究人员目前正在探索是否及如何在人类中激活这个刺猬蛋白信号通路,以预防暴露于空气毒素或糖尿病高风险人群的肺部损伤。
Beachy说,“我们有理由认为长期激活这个刺猬蛋白信号通路可能并非明智之举。我们正在考虑如何以靶向方式刺激该通路,要么用气溶胶将其递送到气道,要么将其靶向到胰腺。我们有初步迹象表明这是可能的。”