许多癌症患者会经历肌肉和脂肪组织的急剧损失。在许多情况下,连心肌也会受到影响,这进一步削弱了身体。这种被称为恶病质(cachexia)的消耗综合征影响着约一半的癌症患者。它是导致治疗抵抗、并发症和死亡率增加的一个主要原因。

如今,在一项新的研究中,来自亥姆霍兹慕尼黑中心的研究人员,与海德堡大学医院、慕尼黑工业大学以及德国糖尿病研究中心合作,发现了一个先前被忽视的恶病质驱动因素:肝脏。肝脏会对其他器官(如肠道或胰腺)中的肿瘤产生系统性反应,并通过释放特定的信号分子来促进组织消耗。该研究发表在《细胞》(Cell)杂志上。
沉默的生物钟基因
在恶病质中,肝脏代谢被根本性地重编程。一个通常调节肝脏全天活动的基因停止了正常功能。研究人员利用小鼠模型发现,这个“内部时钟”几乎完全被关闭了。
“在受影响的实验鼠肝脏中特异性地重新激活这个名为 REV-ERBα 的基因后,体重的损失显著减少了,”论文共同第一作者、亥姆霍兹慕尼黑中心糖尿病与癌症研究所研究员Doris Kaltenecker博士说。另一名论文共同第一作者是Søren Fisker Schmidt博士。
肝脏来源的信号分子驱动恶病质
研究团队表明,REV-ERBα 调控着几个参与肝脏来源信号分子产生的基因。当这个生物钟基因失活时,肝脏会释放出更高水平的促进疾病进展的因子。
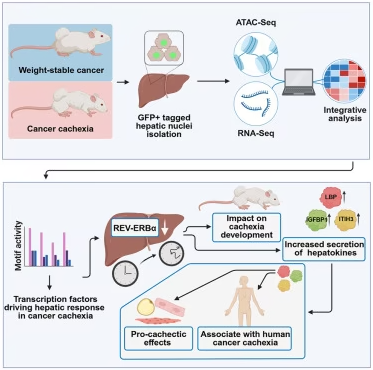
其中三种所谓的肝脏因子(hepatokines)——LBP、ITIH3 和 IGFBP1——是新发现机制的核心。在细胞培养实验中,它们引发了肌肉和脂肪细胞中的分解代谢(组织降解)过程,而这正是导致恶病质中身体消耗的原因。
此外,在患有不同类型癌症的恶病质患者的血液中,这些蛋白质的水平显著升高。在临床前模型中,对这些因子的靶向抑制成功地减轻了它们的有害效应。
诊断和治疗的前景
“我们首次能够证明,肝脏不仅仅是恶病质的被动反应者,而是主动参与了疾病进展,”在亥姆霍兹慕尼黑中心领导这项研究的Mauricio Berriel Diaz博士说。“我们的发现为更好地诊断该综合征和探索治疗干预措施开辟了新的可能性。”
该研究还提供了一个关于肝脏在恶病质中作用的全面数据资源——涵盖从分子网络到细胞类型特异性变化,再到临床前模型中的功能结果。该数据集现已提供给科学界,其用途可以远远超出所研究的模型系统。
从长远来看,所识别的因子可以作为恶病质风险的生物标志物或新疗法的靶点。“鉴于目前还没有获批的治疗恶病质的方法,我们亟需新的途径,”亥姆霍兹慕尼黑中心糖尿病中心主任、糖尿病与癌症研究所所长、慕尼黑工业大学教授Stephan Herzig强调说。“这些结果清晰地证明了系统性器官间相互作用在癌症进展中的重要性。”

