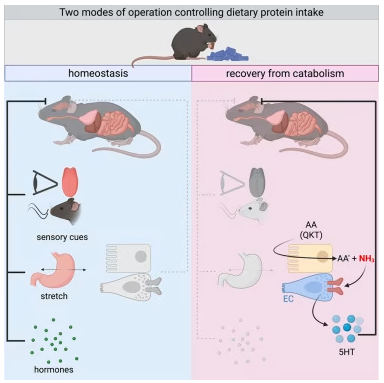
研究的起点是疾病后的 “分解代谢状态”——生病时食欲减退,身体会分解肌肉等组织中的蛋白质供能。为了探究康复期的饮食偏好,研究团队给处于该状态的小鼠提供了三种热量和微量营养素完全一致的饮食,仅宏量营养素不同:高蛋白、高碳水、高脂肪。
结果出人意料:小鼠对高碳水和高脂肪饮食照单全收,却对高蛋白饮食极度排斥,摄食量远低于健康小鼠。进一步实验证实,这种排斥并非暂时的,而是康复期特有的适应性行为——即使在寒冷环境中需要更多能量维持体温,小鼠也宁愿挨饿甚至死亡,也不愿摄入过多蛋白质。
蛋白质由氨基酸构成,研究团队逐一测试了 20 种蛋白质 ogenic 氨基酸,最终锁定了罪魁祸首:谷氨酰胺、赖氨酸、苏氨酸。只要饮食中去除这三种氨基酸,康复期小鼠的食欲就会恢复正常;而单独给小鼠注射这三种氨基酸,会直接引发厌食甚至中毒症状(嗜睡、抽搐、腹泻)。这三种氨基酸的特殊之处在于,它们分解时产生的氨远多于其他氨基酸。氨是强效神经毒素,必须经肝脏尿素循环解毒、肾脏排出,而解毒过程需要大量水分,这也解释了 Jaschke 观察到的奇特现象——长期喂食高蛋白的小鼠,垫料会因过量排尿变得异常潮湿,排尿量是正常情况的 10 倍以上。
更关键的是,康复期小鼠的氨解毒系统本就处于 “满负荷运转” 状态,即生病时肌肉分解已产生大量氨,此时再摄入高蛋白,会让氨浓度超出耐受阈值,引发毒性反应。研究团队发现,当给小鼠提前诱导尿素循环酶表达、增强氨解毒能力后,它们对高蛋白饮食的排斥会明显减弱,甚至能正常摄入富含三种氨基酸的食物,这进一步证实:康复期的蛋白质厌恶,本质是身体避免氨中毒的自我保护。
这条保护机制的核心是一条精密的肠-脑通路。研究团队通过同位素追踪发现,三种氨基酸的氨生成主要发生在十二指肠,这里的肠嗜铬细胞(体内主要的血清素分泌细胞)上,存在一种名为 TRPA1 的受体——它也被称为 “芥末受体”,专门感知有害化学物质。当氨在肠道产生时,会激活肠嗜铬细胞上的 TRPA1,触发血清素释放;血清素随后通过迷走神经传递信号至脑干的最后区和孤束核(这两个区域是食欲和恶心感的核心调控区),最终启动食欲抑制。
为了验证这一通路,研究团队进行了一系列关键实验:敲除小鼠全身的 TRPA1 基因,它们会失去对高蛋白的排斥,仅在肠嗜铬细胞中特异性敲除 TRPA1,同样会导致蛋白质摄入增多;而用药物阻断血清素合成或其受体(5HT3),也会瓦解这种保护机制。反之,激活 TRPA1 受体(比如喂食芥末中的活性成分),会直接抑制康复期小鼠的食欲,复刻高蛋白饮食的效果。这意味着,肠道是氨中毒的 “前哨预警站”,能在氨进入血液循环前就启动防御。
这一发现颠覆了临床长期以来的认知——危重患者康复期通常会被补充高蛋白饮食,认为能修复肌肉损伤。但近年来两项临床试验显示,这种补充不仅无效,反而可能加重病情,与本研究的结论不谋而合。
研究团队指出,虽然实验对象是小鼠,但对人类有重要参考意义:康复期身体的氨解毒能力有限,过量摄入高蛋白会引发氨堆积,反而阻碍恢复。对于尿素循环障碍患者,或许无需全面限制蛋白质,只需避开谷氨酰胺、赖氨酸、苏氨酸含量高的食物(比如酪蛋白),选择 hemp 蛋白这类低 QKT 含量的来源,就能在满足营养需求的同时降低氨中毒风险。
更广泛来看,这项研究还为精神疾病提供了新视角。耶鲁大学医学院 Joseph Luchsinger 博士指出,厌食症、抑郁症等疾病中常见的进食行为异常,可能也与这条肠-脑通路的紊乱有关。未来或许能通过调控 TRPA1 或血清素信号,为这类缺乏有效药物的疾病提供新疗法。
从肠道的氨感知到脑干的食欲调控,这条进化出的保护通路,揭示了康复期身体的 “智慧”——有时 “忌口” 比 “大补” 更重要。未来随着研究深入,有望为康复期患者定制精准饮食方案,甚至开发针对性药物,帮助身体更安全地度过恢复期。而对于我们每个人来说,生病康复期间如果对肉类、鸡蛋等高蛋白食物提不起兴趣,或许不必强迫自己,这可能正是身体在发出 “氨解毒容量不足” 的信号。