无论是心血管疾病的机制解析,还是肿瘤血管靶向药物的研发,都离不开对血管生理特征与病理变化的精准探究。但长期以来,体外研究始终面临瓶颈:二维细胞模型无法还原体内血管的三维微环境与细胞间相互作用,传统动物模型又存在伦理争议与机制研究的局限性。类器官技术的兴起,为突破这一困境提供了关键方向。
近日,Sci Adv发表了一项重要研究,科研团队成功构建出小鼠血液血管类器官(mBVOs),系统揭示其细胞特性与应用价值,为血管生物学研究打开了全新窗口。

研究团队以小鼠胚胎干细胞为起始材料,在优化人类血管类器官分化方案的基础上,通过多步精准调控生成mBVOs:先诱导胚胎干细胞形成胚状体,再依次进行中胚层诱导、血管谱系分化,最后用胶原与Geltrex混合凝胶包埋以促进血管网络萌发。该模型可适配C57BL/6、129S6等多种小鼠品系,研究人员还建立了荧光示踪系统——让VE-钙粘蛋白阳性细胞表达绿色荧光蛋白,实时追踪mBVOs从形成到成熟的全过程,大幅提升了分化效率的筛选精度。更关键的是,将第21天的mBVOs移植到小鼠肾包膜后,它们能在体内逐步成熟:移植4周时仅在边缘出现少量可灌注血管,12周后核心区域便形成了更大规模的可灌注血管网络,充分证实其具备体内功能活性。
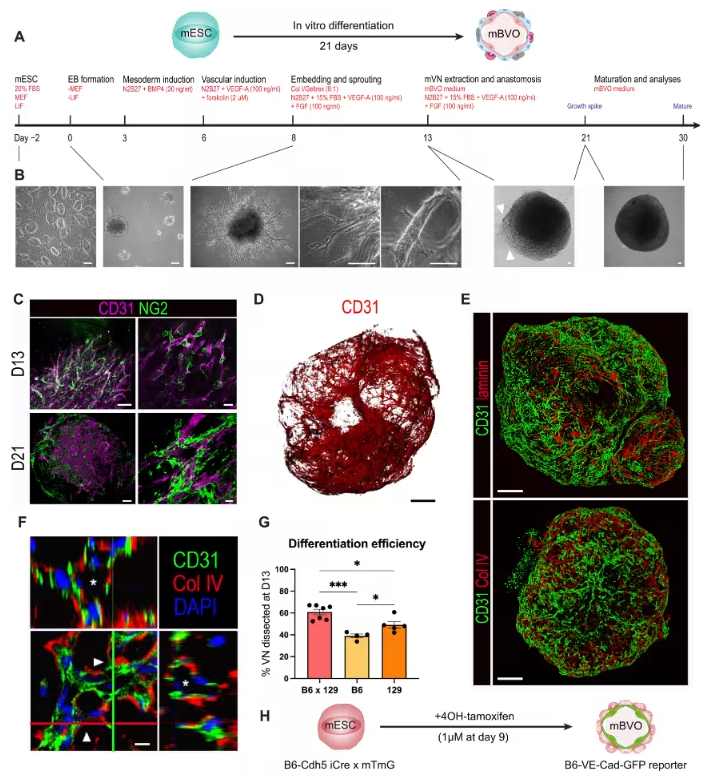
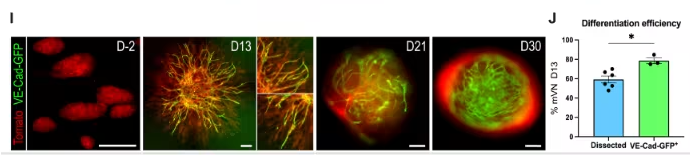
图1:小鼠血液血管类器官的生成
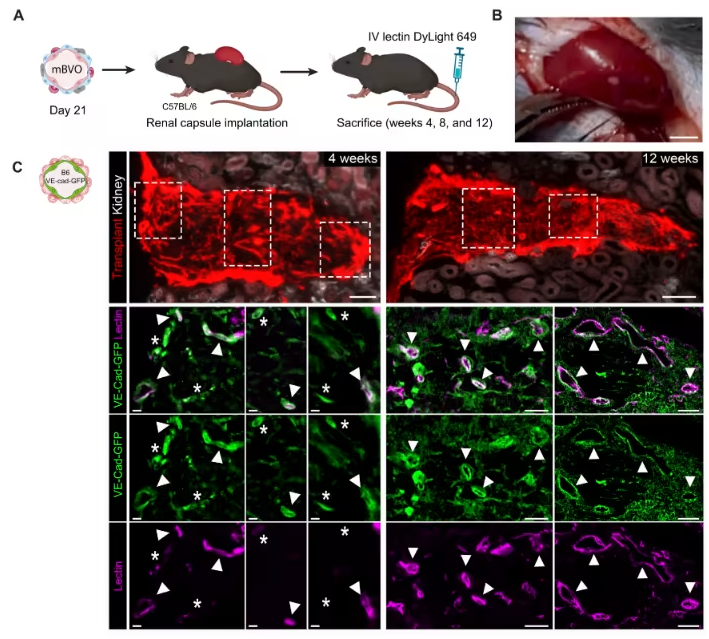
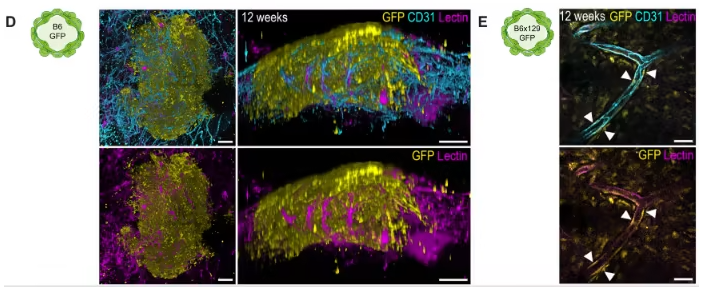
图2:小鼠血液血管类器官移植到同基因或异基因小鼠肾包膜
借助流式细胞术、单细胞RNA测序和整体免疫组化等技术,研究人员进一步解析了mBVOs的细胞组成,发现其在生长高峰期(第21天)和完全成熟期(第30天)均展现出明显的细胞异质性,主要包含三大细胞谱系。其中,内皮细胞占总活细胞的约15%,表达CD31、VE-钙粘蛋白等经典内皮标志物;间充质细胞是主要成分,占比约80%,涵盖周细胞、基质细胞及间充质干细胞样细胞;巨噬细胞占比约3%,多为髓系来源且高表达CD64。值得关注的是内皮细胞的高度可塑性:它们不仅能向动脉、静脉、毛细血管及尖端/茎细胞表型转化,在完全成熟阶段还会呈现神经样特性。单细胞转录组分析更发现,内皮细胞可分为9个亚群,且随时间动态转变——胚胎样亚群在成熟期消失,神经样亚群在成熟期出现,多数亚群还会同时表达动脉、静脉或尖端/茎细胞的特征基因。间充质细胞与巨噬细胞也分别存在12个和4个亚群,随mBVOs成熟呈现出差异化的分化潜能与表型变化。
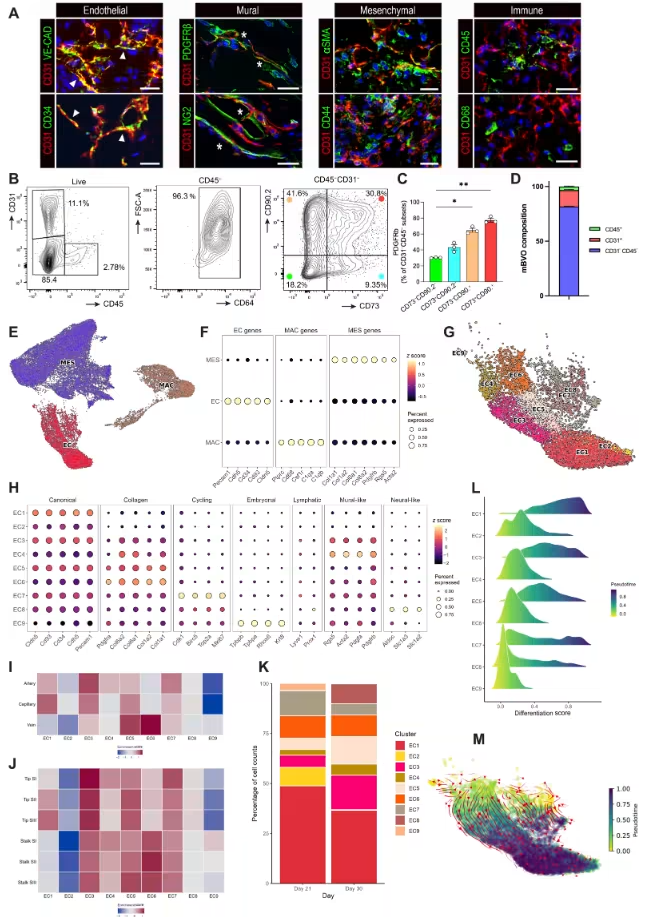
图3:小鼠血液血管类器官的谱系异质性与内皮可塑性
mBVOs的功能适配性同样突出,能在体外精准响应炎症信号与抗血管生成干预。用肿瘤坏死因子α(TNFα)或淋巴毒素β受体激动剂处理72小时后,mBVOs的内皮细胞中细胞间黏附分子1(ICAM-1)表达显著上调,间充质细胞也出现ICAM-1的系统性表达;TNFα还会使巨噬细胞数量翻倍,并让间充质细胞中黏膜血管地址素细胞黏附分子1(MAdCAM-1)的表达提升10倍。而用VEGF中和抗体(B20)或VEGFR2拮抗剂(DC101)阻断VEGF信号后,mBVOs的尺寸、血管密度及周细胞覆盖率均呈剂量依赖性降低,其中B20的作用效果更为显著,充分体现其对血管生成调控的响应能力。
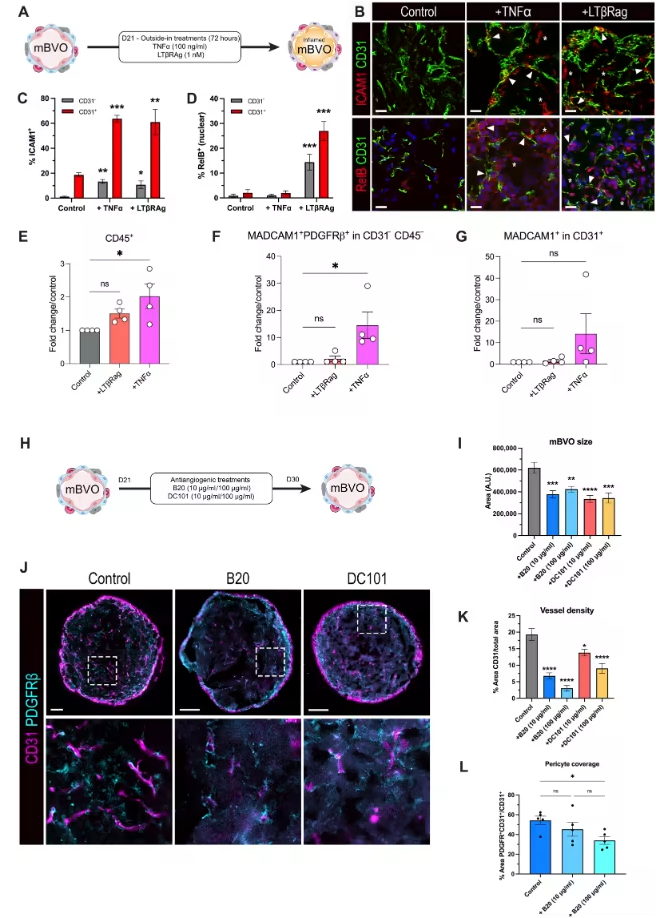
图4:利用炎症信号和抗血管生成药物对小鼠血液血管类器官进行体外调控
为验证mBVOs在肿瘤研究中的价值,团队将其与两种具有不同侵袭模式的胶质母细胞瘤球(NFpp10和NSCG)组装成类器官联合体。结果显示,肿瘤细胞在mBVOs中呈现出与体内一致的生长特征:NFpp10细胞以单细胞形式沿血管侵袭,完美复刻其在小鼠脑内沿血管迁移的模式;NSCG细胞则形成簇状结构破坏血管网络,模拟了其在体内的血管共择生长特性。同时,mBVOs的血管内皮会上调醛缩酶C、谷氨酸转运体及葡萄糖转运体GLUT1的表达,展现出对肿瘤微环境的代谢适应。
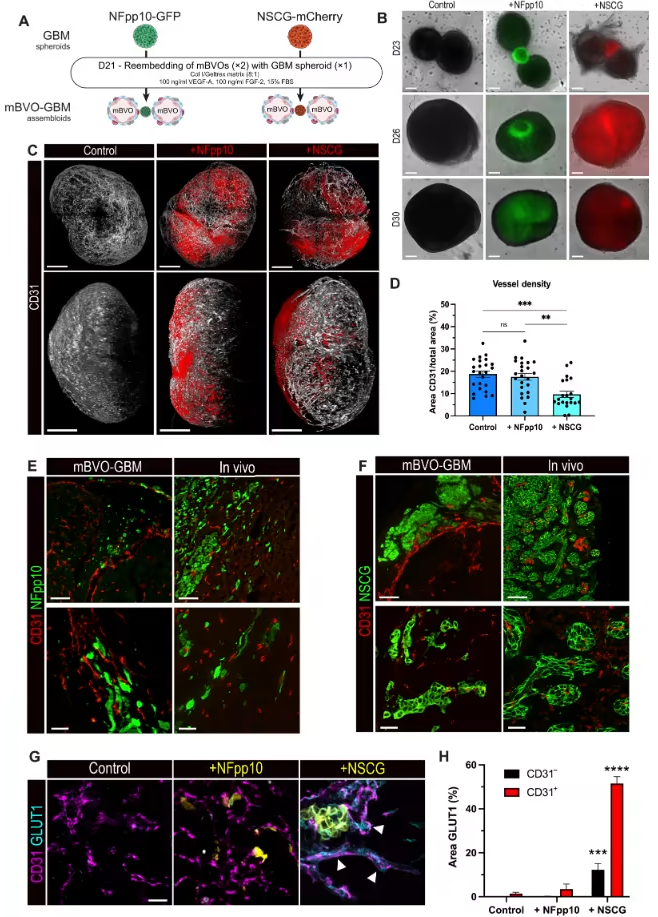
图5:胶质母细胞瘤细胞整合入小鼠血液血管类器官形成类器官联合体
这项研究首次完整构建并深入分析了小鼠血液血管类器官,不仅明确其细胞异质性与动态可塑性,更证实它能在体外精准模拟血管的生理病理反应及肿瘤-血管相互作用。mBVOs的出现,既填补了小鼠血管体外研究模型的空白,也为解析血管发育机制、探究血管相关疾病病理进程提供了可靠工具,同时为血管靶向药物筛选、肿瘤-血管互作研究开辟了新路径。未来,基于mBVOs的研究可进一步拓展至免疫-血管互作、罕见血管病建模等领域,持续推动血管生物学基础研究与临床转化的深度融合,为心血管疾病、肿瘤等血管相关疾病的治疗研发提供更多理论与技术支持。







