狂犬病由嗜神经性狂犬病病毒(RABV)引起,症状出现后致死率接近100%。狂犬病治疗面临的一个根本性挑战在于,血脑屏障(BBB)会阻止外周给药的中和抗体进入中枢神经系统(CNS)以清除感染。
2025年12月23日,华中农业大学赵凌和周明共同通讯(任泽恒及王才茜为论文的共同第一作者)在PNAS 在线发表题为A SynB1-conjugated antibody cocktail crosses the blood–brain barrier to produce a therapeutic effect on rabies的研究论文。该研究首先制备了四种人-鼠嵌合抗体,它们均保留了针对RABV的中和效力,以提升其转化潜力。为实现抗体向脑部的递送,作者将一种先导嵌合抗体(7A3-H)与几种具有潜在BBB穿透能力的细胞穿膜肽(RVG、TGN、THR和SynB1)进行偶联。
体内荧光成像显示,在促进抗体向脑部递送的BBB穿透能力方面,SynB1偶联显著优于其他肽段的偶联。此外,当将靶向RABV-G表位II/III/IV的三抗体鸡尾酒与SynB1偶联,并在感染后第5天(此时CNS入侵和症状已明显)给药时,可使感染致死性攻击病毒标准株(CVS)或犬源狂犬病毒株(DRV)的小鼠存活率达到80%。相比之下,未偶联的抗体鸡尾酒仅能提供20%(CVS)或0%(DRV)的存活率。综上所述,这些数据表明,SynB1介导的BBB穿透能力显著提高了抗RABV抗体的治疗效果,实现了狂犬病症状出现后的救治。这种抗体-肽偶联策略为推进狂犬病治疗提供了概念验证,其核心在于利用肽段介导的BBB穿透能力增强作用。

狂犬病是一种急性感染性疾病,被世界卫生组织归类为人畜共患病。一旦出现临床症状,狂犬病的致死率几乎为100%,每年导致约5万至6万人死亡。目前,狂犬病的预防主要包括暴露后预防(PEP)和暴露前预防(PrEP)。PrEP推荐用于高风险职业人群以及因职业或个人活动可能直接接触感染动物的人群;然而,PrEP不能替代PEP的需要,任何暴露于疑似狂犬病动物的人员仍应寻求暴露后护理。
PEP主要包括彻底的伤口清洗和狂犬病疫苗接种,在严重暴露病例中还需注射狂犬病免疫球蛋白(RIG)。狂犬病在感染早期难以诊断,建议尽早实施PEP,以防止病毒进入中枢神经系统(CNS)。最重要的是,中和抗体等大分子结构药物难以穿过血脑屏障(BBB)到达CNS。因此,探索狂犬病的治疗方法至关重要。
狂犬病病毒属(Lyssavirus)是一类不分节段的负链RNA病毒,其中一种可引发狂犬病。迄今为止,已鉴定出18种狂犬病病毒属病毒。根据遗传距离,已定义出两个主要系统群(系统群I和II)和两个推定系统群(III和IV),其中狂犬病病毒(RABV)是系统群I中首个被鉴定的成员。RABV糖蛋白(RABV-G)是病毒表面暴露的唯一蛋白,包含多个抗原表位。
识别保守糖蛋白表位的抗体,即泛狂犬病病毒属抗体,是开发更有效、更广泛适用疗法的理想选择,但迄今为止,仅有少数此类抗体被报道。先前研究表明,一些单克隆抗体(mAbs)仅靶向RABV-G的单一表位,这使得病毒可通过逃逸突变逃避中和作用,导致治疗失效。此外,已报道了大量靶向RABV-G的小鼠mAbs,但它们可能诱发人抗鼠抗体(HAMA)反应。同时,一些全人源抗体,如Rabishield和CL184,已显示出强大的中和能力,但其开发成本高昂。
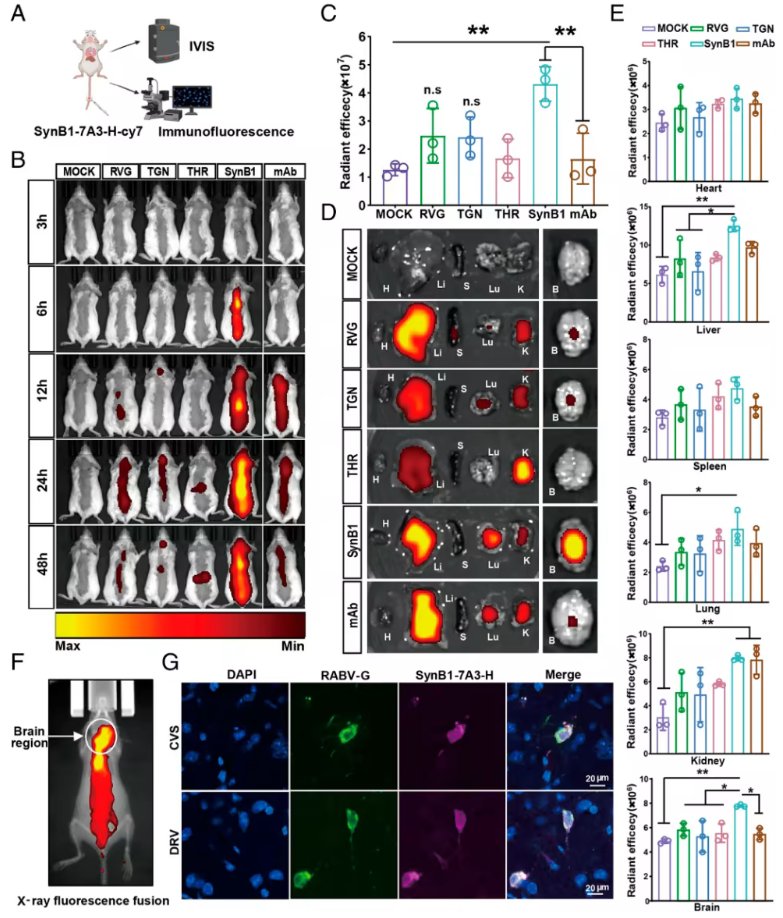
结合脑穿梭肽的人-小鼠嵌合单克隆抗体的脑穿透效应(图片源自PNAS )
人鼠嵌合mAbs因其固有优势已在多种疾病中得到广泛研究。例如,人源化单克隆抗体sutimlimab用于治疗原发性冷凝集素病,其可靶向补体系统中的C1s蛋白以抑制其活化,从而防止红细胞破坏。此外,一项关于嗜神经病毒的研究鉴定出一种人鼠嵌合抗体,可干扰nAChR/RABV-G的交互作用,从而阻断病毒与受体结合;然而,其疗效尚未在动物模型中得到验证。
人鼠嵌合mAbs作为重要的生物医学工具和治疗剂,结合了小鼠mAbs的高亲和力与人源mAbs更好的相容性,为临床治疗和疾病研究提供了理想选择。
BBB是由血管内皮细胞形成的屏障,可阻止大多数物质通过血流进入大脑,包括许多药物和生物分子。这限制了许多基于抗体的药物治疗CNS疾病的疗效。研究人员一直在寻求克服这一局限性的方法。然而,迄今为止,尚无策略展现出令人满意的疗效。
一方面,将药物直接递送至大脑风险高且作用高度局部化;另一方面,修饰分子以增加其跨屏障扩散仅适用于少数小分子药物,且易改变药物自身结构。研究表明,纳米材料可包裹mAbs以穿过BBB,为有效的抗体递送提供了新手段。然而,由于稳定性问题,mAbs的释放以及纳米颗粒在脑微环境中的代谢途径仍需进一步研究。
在本研究中,作者通过抗体工程技术构建了四种人鼠嵌合mAbs,它们能有效中和多种RABV毒株,包括实验室减毒株攻击病毒标准株(CVS)以及两种野生型毒株:犬源狂犬病病毒(DRV)和银毛蝠狂犬病病毒(SHBRV)。
此外,利用来自狂犬病病毒属系统群I和II的五个代表性假病毒,验证了这些嵌合mAbs抗狂犬病的广谱性。通过生物层干涉技术(BLI),作者发现四种mAbs靶向RABV-G的两个常见表位(II和III)以及一个不常见表位IV。最后,作者设计了一种将多种mAbs与BBB穿透肽偶联以治疗狂犬病的策略,BBB穿透肽的偶联有助于mAbs穿过BBB,从而实现症状出现后的狂犬病救治。

